Amfetamiini - Amphetamine
 | |
 | |
| Kliiniset tiedot | |
|---|---|
| Ääntäminen |
/ Æ m f ɛ t ə m i n / ( kuunnella ) |
| Kauppanimet | Evekeo, Adderall , muut |
| Muut nimet | a-metyylifenetyyliamiini |
| AHFS / Drugs.com | Monografia |
| MedlinePlus | a616004 |
| Lisenssitiedot | |
Vastuu riippuvuudesta |
Kohtalainen |
| addiction vastuu |
Kohtalainen |
| Reitit hallinnon |
Lääketieteellinen: suun kautta , laskimoon Virkistys: oraalinen , sisäänpuhallus , peräsuolen , suonensisäinen , lihaksensisäinen |
| Huumeiden luokka | Keskushermostoa stimuloiva , anorektinen |
| ATC -koodi | |
| Oikeudellinen asema | |
| Oikeudellinen asema | |
| Farmakokineettiset tiedot | |
| Biologinen hyötyosuus | Suun kautta: 75–100% |
| Sitoutuminen proteiineihin | 20% |
| Aineenvaihdunta | CYP2D6 , DBH , FMO3 |
| Metaboliitit | 4-hydroksiamfetamiini , 4-hydroxynorephedrine , 4-hydroxyphenylacetone , bentsoehappo , hippuurihappo , norefedriini , fenyyliasetoni |
| Toiminnan alku |
IR -annostus: 30–60 minuuttia XR -annostus: 1,5–2 tuntia |
| Eliminaation puoliintumisaika |
D-amph : 9–11 tuntia L-amph : 11–14 tuntia pH- riippuvainen: 7–34 tuntia |
| Toiminnan kesto |
IR -annostus: 3–6 tuntia XR -annostus: 8–12 tuntia |
| Erittyminen | Ensisijaisesti munuaiset ; pH -riippuvainen alue: 1-75% |
| Tunnisteet | |
| |
| CAS -numero | |
| PubChem CID | |
| IUPHAR/BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| CHEMBL | |
| NIAID ChemDB | |
| CompTox -kojelauta ( EPA ) | |
| ECHA InfoCard |
100,005,543 |
| Kemialliset ja fysikaaliset tiedot | |
| Kaava | C 9 H 13 N |
| Moolimassa | 135,210 g · mol −1 |
| 3D -malli ( JSmol ) | |
| Kiraalisuus | Raseeminen seos |
| Tiheys | 0,936 g/cm 3 25 ° C: ssa |
| Sulamispiste | 11,3 ° C (52,3 ° F) (ennustettu) |
| Kiehumispiste | 203 ° C (397 ° F) 760 mmHg: ssä |
| |
| |
| (tarkista) | |
Amfetamiinia (supistui lpha - m etyyli ph en et HYL amiini ) on keskushermoston (CNS) stimulantti , jota käytetään hoidettaessa ylivilkkaushäiriön (ADHD), narkolepsia , ja lihavuus . Amfetamiini löydettiin vuonna 1887 ja sitä esiintyy kahdena enantiomeerinä : levoamfetamiini ja dekstroamfetamiini . Amfetamiini viittaa oikein tiettyyn kemikaaliin, raseemiseen vapaaseen emäkseen , joka on yhtä suuri osa kahdesta enantiomeeristä, levoamfetamiinista ja dekstroamfetamiinista, puhtaissa amiinimuodoissaan. Termiä käytetään usein epävirallisesti viittaamaan mihin tahansa enantiomeerien yhdistelmään tai kumpaankin niistä yksinään. Historiallisesti sitä on käytetty nenän tukkoisuuden ja masennuksen hoitoon. Amfetamiinia käytetään myös urheilullisen suorituskyvyn ja kognitiivisen tehostajana sekä virkistyskäyttöön aphrodisiacina ja euforianttina . Se on reseptilääke monissa maissa, ja amfetamiinin luvatonta hallussapitoa ja jakelua valvotaan usein tiukasti virkistyskäyttöön liittyvien merkittävien terveysriskien vuoksi .
Ensimmäinen amfetamiinilääke oli Benzedrine , tuotemerkki, jota käytettiin erilaisten sairauksien hoitoon. Tällä hetkellä farmaseuttinen amfetamiini on määrätty raseemiseksi amfetamiiniksi, Adderalliksi , dekstroamfetamiiniksi tai inaktiiviseksi aihiolääkkeeksi lisdeksamfetamiiniksi . Amfetamiini lisää monoamiinia ja kiihottavaa neurotransmissiota aivoissa, ja sen voimakkaimmat vaikutukset kohdistuvat noradrenaliinin ja dopamiinin välittäjäainejärjestelmiin .
Terapeuttisia annoksia, amfetamiini aiheuttaa emotionaalista ja kognitiivista vaikutuksia, kuten euforiaa , muutos halua seksiä , lisääntynyt valveillaolon ja parantaa kognitiivista kontrollia . Se aiheuttaa fyysisiä vaikutuksia, kuten parantunutta reaktioaikaa, väsymiskestävyyttä ja lisääntynyttä lihasvoimaa. Suuremmat amfetamiiniannokset voivat heikentää kognitiivista toimintaa ja aiheuttaa nopeaa lihasten hajoamista . Riippuvuus on vakava riski amfetamiinin runsaan virkistyskäytön yhteydessä, mutta epätodennäköistä, että sitä ilmenee pitkäaikaisesta lääketieteellisestä käytöstä terapeuttisina annoksina. Hyvin suuret annokset voivat johtaa psykoosiin (esim. Harhaluulot ja vainoharhaisuus ), jota esiintyy harvoin terapeuttisilla annoksilla jopa pitkäaikaisessa käytössä. Virkistysannokset ovat yleensä paljon suurempia kuin määrätyt terapeuttiset annokset, ja niillä on paljon suurempi vakavien sivuvaikutusten riski.
Amfetamiini kuuluu fenetyyliamiiniluokkaan . Se on myös oman rakenteellisen luokkansa lähtöaine , substituoidut amfetamiinit , jotka sisältävät merkittäviä aineita, kuten bupropionia , katinonia , MDMA : ta ja metamfetamiinia . Fenetyyliamiiniluokan jäsenenä amfetamiini liittyy kemiallisesti myös luonnossa esiintyviin pieniin amiinien neuromodulaattoreihin, erityisesti fenetyyliamiiniin ja N -metyylifenetyyliamiiniin , jotka molemmat tuotetaan ihmiskehossa. Fenetyyliamiini on amfetamiinin lähtöyhdiste, kun taas N -metyylifenetyyliamiini on amfetamiinin paikallinen isomeeri , joka eroaa vain metyyliryhmän sijoittelusta .
Käyttää
Lääketieteellinen
Amfetamiinia hoidetaan tarkkaavaisuus- ja ylivilkkaushäiriö (ADHD), narkolepsia (unihäiriö), ja lihavuus , ja on joskus määrätty off-label sen menneisyyden lääketieteellisiä viitteitä , etenkin masennuksen ja kroonisen kivun . Pitkäaikaisen amfetamiinialtistuksen riittävän suurina annoksina tiedetään joissakin eläinlajeissa aiheuttavan epänormaalia dopamiinijärjestelmän kehitystä tai hermovaurioita, mutta ADHD-potilailla lääketeollisuuden amfetamiinit terapeuttisina annoksina näyttävät parantavan aivojen kehitystä ja hermojen kasvua. Arvostelut magneettikuvaus (MRI), tutkimukset viittaavat siihen, että pitkäaikainen hoito amfetamiinin laskee aivojen rakenteellisia ja toiminta löytyy henkilöillä, joilla on ADHD, ja parantaa funktio useissa osissa aivoja, kuten oikeus häntätumakkeessa ja basaaliganglioiden .
Kliinisten stimulanttitutkimusten arviot ovat osoittaneet, että amfetamiinin pitkäaikainen käyttö ADHD: n hoidossa on turvallista ja tehokasta. Satunnaistetut kontrolloidut tutkimukset jatkuvasta stimulanttihoidosta 2 vuoden ajan ADHD: n hoitoon ovat osoittaneet hoidon tehokkuuden ja turvallisuuden. Kaksi arvostelua on osoittanut, että ADHD: n pitkäaikainen jatkuva stimulanttihoito on tehokas ADHD: n perusoireiden (eli yliaktiivisuuden, tarkkaamattomuuden ja impulsiivisuuden) vähentämisessä, elämänlaadun ja akateemisten saavutusten parantamisessa ja monien toiminnallisten parannusten parantamisessa. tulokset yhdeksässä tulosryhmässä, jotka liittyvät tutkijoihin, epäsosiaaliseen käyttäytymiseen, ajamiseen, ei-lääkkeelliseen käyttöön, liikalihavuuteen, ammattiin, itsetuntoon, palvelujen käyttöön (eli akateemiseen, ammatilliseen, terveyteen, taloudelliseen ja oikeudelliseen palveluun) ja sosiaaliseen toimintaan . Eräässä katsauksessa korostettiin yhdeksän kuukauden satunnaistettua kontrolloitua tutkimusta ADHD: n amfetamiinihoidosta lapsilla, joiden keskimääräinen nousu oli 4,5 IQ- pistettä, huomion lisääntyminen jatkui ja häiritsevän käyttäytymisen ja hyperaktiivisuuden väheneminen jatkui. Toinen katsaus osoitti, että pisin tähän mennessä tehtyjen seurantatutkimusten perusteella lapsuudessa alkava elinikäinen stimulanttihoito on jatkuvasti tehokas ADHD-oireiden hallitsemiseksi ja vähentää riskiä sairastua päihteidenkäyttöhäiriöön aikuisena.
Nykyiset ADHD -mallit viittaavat siihen, että se liittyy joidenkin aivojen välittäjäainejärjestelmien toimintahäiriöihin ; Näiden toimintarajoitteisille joihin liittyvät heikentynyt dopamiinin neurotransmissiota mesokortikolimbisiä projektio ja noradrenaliinin neurotransmissiota noradrenergiselle ennusteet sinertävä aivotäplä on etuaivokuoren . Psykostimulantit, kuten metyylifenidaatti ja amfetamiini, ovat tehokkaita ADHD: n hoidossa, koska ne lisäävät välittäjäaineaktiivisuutta näissä järjestelmissä. Noin 80% näitä piristeitä käyttävistä näkee parannuksia ADHD -oireissa. ADHD -lapsilla, jotka käyttävät piristäviä lääkkeitä, on yleensä paremmat suhteet ikäisensä ja perheenjäsentensä kanssa, he menestyvät paremmin koulussa, ovat vähemmän häiritseviä ja impulsiivisia ja heillä on pidempi huomiota. Cochrane katsauksia ADHD lapsilla, nuorilla ja aikuisilla lääketeollisuuden amfetamiinia totesi, että lyhyen aikavälin tutkimukset ovat osoittaneet, että nämä lääkkeet vähentävät oireiden vakavuuden, mutta ne ovat korkeammat lopettamisen hinnat kuin ei-stimulanttilääkityksen johtuen niiden haittavaikutusten haittavaikutuksia . Cochrane -katsaus ADHD: n hoidosta lapsilla, joilla on tic -häiriöitä , kuten Touretten oireyhtymä, osoitti, että piristeet eivät yleensä pahenna tikiä , mutta suuret dekstroamfetamiiniannokset voivat pahentaa tikkejä joillakin yksilöillä.
Suorituskyvyn parantaminen
Kognitiivinen suorituskyky
Vuonna 2015 laadukkaiden kliinisten tutkimusten systemaattisessa katsauksessa ja meta-analyysissä havaittiin, että pienillä (terapeuttisilla) annoksilla käytettynä amfetamiini tuottaa vaatimattomia, mutta yksiselitteisiä parannuksia kognitioon, mukaan lukien työmuisti , pitkäaikainen episodimuisti , esto-ohjaus , ja joitakin huomion näkökohtia , terveillä aikuisilla; näiden amfetamiinin kognitiota parantavien vaikutusten tiedetään välittävän osittain sekä dopamiinireseptorin D 1 että adrenoreseptori a 2 : n epäsuoran aktivoitumisen kautta prefrontaalisessa aivokuoressa . Vuonna 2014 tehdyssä järjestelmällisessä katsauksessa todettiin, että pienet amfetamiiniannokset parantavat myös muistin vakauttamista , mikä puolestaan johtaa tietojen parempaan palauttamiseen . Terapeuttiset amfetamiiniannokset parantavat myös aivokuoren verkoston tehokkuutta. Amfetamiini ja muut ADHD-stimulantit parantavat myös tehtävien suvaitsevaisuutta (motivaatiota tehtävän suorittamiseen) ja lisäävät kiihottumista (heräämistä), mikä puolestaan edistää tavoiteltua käyttäytymistä. Stimulantit, kuten amfetamiini, voivat parantaa suorituskykyä vaikeissa ja tylsissä tehtävissä, ja jotkut opiskelijat käyttävät niitä opiskelu- ja testiapuna. Perustuu tutkimuksiin, oman ilmoituksensa laittomien piristeiden käyttö, 5-35% opiskelijoiden käytä siirretään ADHD piristeitä, jota käytetään pääasiassa parantamiseksi koulumenestykseen pikemminkin kuin vapaa-ajan huumeet. Suuret terapeuttisen alueen yläpuolella olevat amfetamiiniannokset voivat kuitenkin häiritä työmuistia ja muita kognitiivisen hallinnan näkökohtia.
Fyysinen suorituskyky
Jotkut urheilijat käyttävät amfetamiinia psykologisiin ja urheilullisiin suorituskykyä parantaviin vaikutuksiinsa , kuten kestävyyden ja valppauden lisäämiseen; ei-lääketieteellinen amfetamiinin käyttö on kuitenkin kielletty urheilutapahtumissa, joita säätelevät kollegiaaliset, kansalliset ja kansainväliset antidopingtoimistot. Terveillä ihmisillä suun kautta otetuilla terapeuttisilla annoksilla amfetamiinin on osoitettu lisäävän lihasvoimaa , kiihtyvyyttä, urheilullista suorituskykyä anaerobisissa olosuhteissa ja kestävyyttä (ts. Se viivästyttää väsymyksen alkamista ) ja samalla parantamaan reaktioaikaa . Amfetamiini parantaa kestävyyttä ja reaktioaikaa pääasiassa estämällä takaisinottoa ja vapauttamalla dopamiinia keskushermostossa. Amfetamiini ja muut dopaminergiset lääkkeet lisäävät myös tehoa kiinteillä havaitun rasituksen tasoilla ohittamalla "turvakytkimen", jolloin ydinlämpötilaraja voi nousta, jotta voidaan käyttää varalla olevaa kapasiteettia, joka on normaalisti rajojen ulkopuolella. Terapeuttisina annoksina amfetamiinin haittavaikutukset eivät estä urheilullista suorituskykyä. paljon suuremmilla annoksilla amfetamiini voi kuitenkin aiheuttaa vaikutuksia, jotka heikentävät vakavasti suorituskykyä, kuten nopeaa lihasten hajoamista ja kohonnutta kehon lämpötilaa .
Vasta -aiheet
Mukaan Kansainvälisen kemikaaliturvallisuusohjelman (IPCS) ja Yhdysvaltain elintarvike- ja lääkevirasto (USFDA), amfetamiinia aiheinen henkilöillä, joilla on ollut huumeiden väärinkäytön , sydän- ja verisuonisairaudet , vaikea agitaatio tai vaikea ahdistuneisuus. Se on vasta -aiheinen myös henkilöille, joilla on pitkälle edennyt ateroskleroosi (valtimoiden kovettuminen), glaukooma (kohonnut silmänpaine), kilpirauhasen liikatoiminta ( kilpirauhashormonin liiallinen tuotanto) tai kohtalainen tai vaikea hypertensio . Nämä virastot osoittavat, että ihmiset, jotka ovat kokeneet allergisia reaktioita muille piristeille tai jotka käyttävät monoamiinioksidaasin estäjiä (MAOI), eivät saa ottaa amfetamiinia, vaikka amfetamiinin ja monoamiinioksidaasin estäjien samanaikainen käyttö on dokumentoitu. Nämä virastot ilmoittavat myös, että kaikkien, joilla on anoreksia nervosa , kaksisuuntainen mielialahäiriö , masennus, kohonnut verenpaine, maksa- tai munuaisongelmat, mania , psykoosi , Raynaud'n ilmiö , kohtaukset , kilpirauhasongelmat , tikit tai Touretten oireyhtymä, tulee seurata oireitaan amfetamiinin käytön aikana. Ihmistutkimuksista saadut todisteet osoittavat, että terapeuttinen amfetamiinin käyttö ei aiheuta kehityshäiriöitä sikiölle tai vastasyntyneille (eli se ei ole ihmisen teratogeeni ), mutta amfetamiinin väärinkäyttö aiheuttaa riskejä sikiölle. Amfetamiinin on myös osoitettu erittyvän rintamaitoon, joten IPCS ja USFDA neuvovat äitejä välttämään imettämistä sitä käytettäessä. Käänteisten kasvuhäiriöiden vuoksi USFDA neuvoo seuraamaan amfetamiinilääkkeen määräävien lasten ja nuorten pituutta ja painoa.
Haittavaikutukset
Haitallisia sivuvaikutuksia amfetamiinin on monia ja vaihteli, ja määrää amfetamiinin käytetään ensisijainen tekijä määritettäessä todennäköisyys ja vakavuus haittavaikutuksia. Amfetamiinituotteet, kuten Adderall , Dexedrine ja niiden vastaavat, ovat tällä hetkellä USFDA: n hyväksymiä pitkäaikaiseen terapeuttiseen käyttöön. Amfetamiinin virkistyskäyttö sisältää yleensä paljon suurempia annoksia, joilla on suurempi riski vakavista haittavaikutuksista kuin terapeuttisiin tarkoituksiin käytettävillä annoksilla.
Fyysinen
Kardiovaskulaarisia sivuvaikutuksia voivat olla verenpainetauti tai hypotensio siitä vasovagaalinen vastauksen , Raynaud'n oireyhtymä (heikentynyt verenvirtaus käsien ja jalkojen), ja takykardia (sydämen tiheälyöntisyys). Seksuaalisia sivuvaikutuksia miehillä voi olla erektiohäiriö , usein erektio tai pitkittynyt erektio . Ruoansulatuskanavan haittavaikutuksia voivat olla vatsakipu , ummetus , ripuli ja pahoinvointi . Muita mahdollisia fyysisiä sivuvaikutuksia ovat ruokahaluttomuus , näön hämärtyminen , suun kuivuminen , liiallinen hampaiden narskuttaminen , nenäverenvuoto, runsas hikoilu, rhinitis medicamentosa (lääkkeen aiheuttama nenän tukkoisuus), kouristuskynnyksen lasku , tikit (eräänlainen liikehäiriö) ja laihtuminen . Vaaralliset fyysiset sivuvaikutukset ovat harvinaisia tyypillisillä farmaseuttisilla annoksilla.
Amfetamiini stimuloi medullaarisia hengityskeskuksia ja tuottaa nopeampia ja syvempiä hengityksiä. Normaalilla ihmisellä terapeuttisilla annoksilla tämä vaikutus ei yleensä ole havaittavissa, mutta kun hengitys on jo heikentynyt, se voi olla ilmeistä. Amfetamiini myös indusoi supistuminen virtsan virtsarakon sulkijalihaksen , lihaksen joka valvontaa virtsaaminen, mikä voi johtaa vaikeuksiin virtsaamista. Tämä vaikutus voi olla hyödyllinen sängyn kostutuksen ja virtsarakon hallinnan menetyksen hoidossa . Amfetamiinin vaikutukset ruoansulatuskanavaan ovat arvaamattomia. Jos suoliston aktiivisuus on korkea, amfetamiini voi vähentää ruoansulatuskanavan motiliteettia (nopeutta, jolla sisältö liikkuu ruoansulatuskanavan läpi); amfetamiini voi kuitenkin lisätä liikkuvuutta, kun suoliston sileä lihas on rento. Amfetamiinilla on myös lievä kipua lievittävä vaikutus ja se voi parantaa opioidien kipua lievittävää vaikutusta .
USFDA: n tilatut tutkimukset vuodelta 2011 osoittavat, että lapsilla, nuorilla aikuisilla ja aikuisilla ei ole yhteyttä vakavien sydän- ja verisuonitapahtumien ( äkillinen kuolema , sydänkohtaus ja aivohalvaus ) ja amfetamiinin tai muiden ADHD-stimulanttien lääketieteellisen käytön välillä. Amfetamiinilääkkeet ovat kuitenkin vasta -aiheisia henkilöille, joilla on sydän- ja verisuonisairaus .
Psykologinen
Normaaleilla terapeuttisilla annoksilla amfetamiinin yleisimpiä psykologisia sivuvaikutuksia ovat lisääntynyt valppaus , ahdistus, keskittymiskyky , oma- aloitteisuus, itseluottamus ja sosiaalisuus, mielialan vaihtelut ( kohonnut mieliala ja lievästi masentunut mieliala ), unettomuus tai herääminen ja vähentynyt väsymyksen tunne . Harvempia sivuvaikutuksia ovat ahdistuneisuus , libidon muutos , suurenmoisuus , ärtyneisyys , toistuva tai pakkomielteinen käyttäytyminen ja levottomuus; nämä vaikutukset riippuvat käyttäjän persoonallisuudesta ja tämänhetkisestä henkisestä tilasta. Amfetamiinipsykoosia (esim. Harhaluuloja ja vainoharhaisuutta ) voi esiintyä raskailla käyttäjillä. Vaikka tämä psykoosi on hyvin harvinainen, sitä voi esiintyä myös terapeuttisina annoksina pitkäaikaishoidon aikana. USFDA: n mukaan "ei ole systemaattista näyttöä" siitä, että piristeet aiheuttavat aggressiivista käyttäytymistä tai vihamielisyyttä.
Amfetamiinin on myös osoitettu tuottavan ehdollisen paikkavalinnan ihmisillä, jotka käyttävät terapeuttisia annoksia, mikä tarkoittaa, että yksilöt haluavat mieluummin viettää aikaa paikoissa, joissa he ovat aiemmin käyttäneet amfetamiinia.
Vahvistushäiriöt
Riippuvuus
| Riippuvuuden ja riippuvuuden sanasto | |
|---|---|
| |
| Transkriptiotekijän sanasto | |
|---|---|
| |
|
|
Riippuvuus on vakava riski, kun amfetamiinia käytetään runsaasti virkistyskäyttöön, mutta sitä ei todennäköisesti synny pitkäaikaisesta lääketieteellisestä käytöstä terapeuttisina annoksina. Itse asiassa lapsuudessa alkava ADHD: n elinikäinen stimulanttihoito vähentää riskiä sairastua päihdeongelmiin aikuisena. Patologinen yliaktivaatiota mesolimbiseen , joka on dopamiini polku , joka yhdistää ventraaliseen tegmentaalialueeseen että accumbens-tumakkeessa , on keskeinen rooli amfetamiiniaddiktio. Yksilöillä, jotka usein käyttävät itse suuria annoksia amfetamiinia, on suuri riski sairastua amfetamiiniriippuvuuteen, koska pitkäaikainen käyttö suurina annoksina lisää vähitellen Accumbaalisen ΔFosB: n , "molekyylikytkimen" ja " pääkontrolliproteiinin " tasoa riippuvuuteen. Kun ydin accumbens ΔFosB on riittävästi yliekspressoitu, se alkaa lisätä riippuvuutta aiheuttavan käyttäytymisen vakavuutta (eli pakko-oireista huumeiden etsintää) ja sen ilmentyminen kasvaa edelleen. Vaikka tällä hetkellä ei ole olemassa tehokkaita lääkkeitä amfetamiiniriippuvuuden hoitoon, säännöllinen jatkuva aerobinen harjoittelu näyttää vähentävän tällaisen riippuvuuden kehittymisen riskiä. Säännöllinen säännöllinen aerobinen liikunta näyttää myös olevan tehokas hoito amfetamiiniriippuvuudelle; kuntohoito parantaa kliinisen hoidon tuloksia ja sitä voidaan käyttää lisähoitona riippuvuuden käyttäytymisterapioiden kanssa.
Biomolekulaariset mekanismit
Krooninen amfetamiinin on liian suuret annokset aiheuttaa muutoksia geenien ilmentyminen on mesokortikolimbisiä projektio , joka syntyä transkription ja epigeneettisellä mekanismeja. Tärkeimmät transkriptiotekijät, jotka aiheuttavat näitä muutoksia, ovat hiiren Delta FBJ: n osteosarkooman viruksen onkogeenihomologi B ( ΔFosB ), cAMP- vaste-elementtiä sitova proteiini ( CREB ) ja ydintekijä -kappa B ( NF-KB ). ΔFosB on merkittävin biomolekyylitason mekanismi riippuvuus koska ΔFosB yliekspressio (eli epänormaalin korkea geeni-ilmentymisen, joka tuottaa voimakas geenin liittyvän fenotyypin ) on D1-tyyppinen väliaine piikkiorakon neuronit , että nucleus accumbens on välttämätön ja riittävä moniin hermoston sopeutumiset ja säätelevät riippuvuuteen liittyviä käyttäytymiseen liittyviä vaikutuksia (esim. palkitsemisen herkistyminen ja lisääntyvä huumeiden itsehallinto ). Kun ΔFosB on riittävästi yliekspressoitu, se aiheuttaa riippuvuutta aiheuttavan tilan, joka muuttuu yhä vakavammaksi, kun ΔFosB -ilmentyminen lisääntyy edelleen. Se on liittynyt muun muassa alkoholin , kannabinoidien , kokaiinin , metyylifenidaatin , nikotiinin , opioidien , fensyklidiinin , propofolin ja substituoitujen amfetamiinien riippuvuuksiin .
ΔJunD , transkriptiotekijä ja G9a , histonimetyylitransferaasientsyymi , molemmat vastustavat ΔFosB: n toimintaa ja estävät sen ilmentymisen lisääntymistä. Riittävästi yliekspressoiva ΔJunD ytimessä ytimessä virusvektorien kanssa voi estää kokonaan monia kroonisessa huumeidenkäytössä havaittuja hermo- ja käyttäytymismuutoksia (ts. ΔFosB: n välittämiä muutoksia). Vastaavasti, accumbal G9a hyperilmentämisestä johtaa selvästi lisääntynyt histonin 3 lysiinin jäännös 9 dimetyloimalla ( H3K9me2 ) ja estää induktio ΔFosB-välitteisen neuraalisen ja käyttäytymiseen plastisuus kroonisen huumeiden käyttö, joka tapahtuu kautta H3K9me2 n välittämä tukahduttaminen on transkriptiotekijöiden varten ΔFosB ja H3K9me2- eri ΔFosB -transkription kohteiden (esim. CDK5 ) välittämä tukahduttaminen . ΔFosB: llä on myös tärkeä rooli säätelemällä käyttäytymisvasteita luonnollisiin palkintoihin , kuten maukasta ruokaa, seksiä ja liikuntaa. Koska sekä luonnolliset palkinnot että riippuvuutta aiheuttavat lääkkeet aiheuttavat ΔFosB: n ilmentymistä (eli ne saavat aivot tuottamaan enemmän sitä), näiden palkkioiden krooninen hankkiminen voi johtaa samanlaiseen patologiseen riippuvuuteen. Näin ollen ΔFosB on merkittävin tekijä, joka liittyy sekä amfetamiiniriippuvuuteen että amfetamiinin aiheuttamiin seksuaaliriippuvuuksiin , jotka ovat pakonomaista seksuaalista käyttäytymistä, joka johtuu liiallisesta seksuaalisesta toiminnasta ja amfetamiinin käytöstä. Nämä seksuaaliset riippuvuudet liittyvät dopamiinin toimintahäiriöoireyhtymään, jota esiintyy joillakin potilailla, jotka käyttävät dopaminergisiä lääkkeitä .
Amfetamiinin vaikutukset geenien säätelyyn ovat sekä annoksesta että reitistä riippuvaisia. Suurin osa geenien säätelyä ja riippuvuutta koskevista tutkimuksista perustuu eläinkokeisiin, joissa amfetamiinia annetaan laskimonsisäisesti erittäin suurina annoksina. Muutamat tutkimukset, joissa on käytetty vastaavia (painolle mukautettuja) ihmisen terapeuttisia annoksia ja suun kautta tapahtuvaa antoa, osoittavat, että nämä muutokset, jos ne tapahtuvat, ovat suhteellisen vähäisiä. Tämä viittaa siihen, että amfetamiinin lääketieteellinen käyttö ei vaikuta merkittävästi geenien säätelyyn.
Farmakologiset hoidot
Joulukuusta 2019 lähtien ei ole olemassa tehokasta farmakoterapiaa amfetamiiniriippuvuuteen. Vuosien 2015 ja 2016 arviot osoittivat, että TAAR1 -selektiivisillä agonisteilla on merkittävä terapeuttinen potentiaali psykostimulanttiriippuvuuden hoidossa; kuitenkin helmikuusta 2016 lähtien ainoat yhdisteet, joiden tiedetään toimivan TAAR1-selektiivisinä agonisteina, ovat kokeellisia lääkkeitä . Amfetamiiniriippuvuus välittyy suurelta osin lisääntyneen dopamiinireseptorien ja rinnakkain lokalisoitujen NMDA-reseptorien aktivoitumisen myötä ytimessä; magnesiumionit estävät NMDA -reseptoreita estämällä reseptorin kalsiumkanavan . Eräässä katsauksessa ehdotettiin, että eläinkokeiden perusteella patologinen (riippuvuutta aiheuttava) psykostimulanttien käyttö alentaa merkittävästi solunsisäisen magnesiumin määrää koko aivoissa. Täydentävän magnesiumhoidon on osoitettu vähentävän amfetamiinin itseannostelua (eli itselleen annettuja annoksia) ihmisillä, mutta se ei ole tehokas monoterapia amfetamiiniriippuvuuteen.
Järjestelmällisessä katsauksessa ja meta-analyysissä vuodelta 2019 arvioitiin 17 eri farmakoterapian tehoa, joita käytettiin RCT-tutkimuksissa amfetamiini- ja metamfetamiiniriippuvuuteen; se löysi vain vähäisiä todisteita siitä, että metyylifenidaatti saattaa vähentää amfetamiinin tai metamfetamiinin itseannostelua. Useista muista, rintasyöpäsairauksissa käytetyistä lääkkeistä, joita olivat masennuslääkkeet (bupropioni, mirtatsapiini , sertraliini ), psykoosilääkkeet ( aripipratsoli ), kouristuksia estävät lääkkeet ( topiramaatti , baklofeeni , gabapentiini ), naltreksoni , varenikliini , ei ollut todisteita siitä, että niistä ei olisi hyötyä. , sitikoliini , ondansetroni , prometa , rilutsoli , atomoksetiini , dekstroamfetamiini ja modafiniili .
Käyttäytymishoidot
Vuonna 2018 tehdyssä systemaattisessa katsauksessa ja verkoston meta-analyysissä 50 tutkimusta, joihin osallistui 12 erilaista psykososiaalista toimenpidettä amfetamiinin, metamfetamiinin tai kokaiinin riippuvuuden osalta, havaittiin, että yhdistelmähoidolla, jossa oli sekä varautumisen hallinta että yhteisön vahvistamismenetelmä, oli suurin tehokkuus (eli pidättymisaste) ja hyväksyttävyys ( eli alhaisin keskeyttämisaste). Muita analyysissä tutkittuja hoitomuotoja olivat monoterapia, jossa on valmiushallinta tai yhteisön vahvistamismenetelmä, kognitiivinen käyttäytymisterapia , 12-vaiheiset ohjelmat , ei-ehdolliset palkitsemiseen perustuvat hoidot, psykodynaaminen hoito ja muut yhdistelmähoidot, joihin nämä liittyvät.
Lisäksi fyysisen harjoituksen neurobiologisia vaikutuksia koskeva tutkimus viittaa siihen, että päivittäinen aerobinen liikunta, erityisesti kestävyysharjoittelu (esim. Maratonjuoksu ), estää huumeriippuvuuden kehittymisen ja on tehokas lisähoito (ts. Lisähoito ) amfetamiiniriippuvuuteen. Liikunta johtaa parempiin hoitotuloksiin, kun sitä käytetään lisähoitona, erityisesti psykostimulanttiriippuvuuksissa. Erityisesti, aerobinen liikunta laskee psykostimulantti itseannostelua vähentää uudelleen (eli uusiutumisen) huumeiden tavoitteluun, ja indusoi lisääntynyt dopamiinireseptorin D 2 (DRD2) tiheys striatumissa . Tämä on päinvastoin kuin patologinen stimulanttien käyttö, mikä aiheuttaa striataalisen DRD2 -tiheyden pienenemisen. Eräässä katsauksessa todettiin, että liikunta voi myös estää huumeriippuvuuden kehittymisen muuttamalla ΔFosB- tai c-Fos- immunoreaktiivisuutta striatumissa tai muissa palkitsemisjärjestelmän osissa .
| Muoto neuroplasticity tai käyttäytymiseen plastisuus |
Tyyppinen vahvistajana | Lähteet | |||||
|---|---|---|---|---|---|---|---|
| Opiaatit | Psykostimulantit | Rasvainen tai sokerinen ruoka | Seksuaalinen kanssakäyminen |
Liikunta (aerobinen) |
Ympäristön rikastaminen |
||
|
ΔFosB- ilmentyminen ytimessä accumbens D1-tyypin MSN: issä |
↑ | ↑ | ↑ | ↑ | ↑ | ↑ | |
| Käyttäytymisen plastisuus | |||||||
| Saannin lisääntyminen | Joo | Joo | Joo | ||||
| Psykostimulanttien ristiherkistyminen |
Joo | Ei sovellettavissa | Joo | Joo | Vaimennettu | Vaimennettu | |
| Psykostimulantti itsehallinto |
↑ | ↑ | ↓ | ↓ | ↓ | ||
| Psykostimulantti ehdollinen paikka |
↑ | ↑ | ↓ | ↑ | ↓ | ↑ | |
| Huumeidenkäyttäytymisen palauttaminen | ↑ | ↑ | ↓ | ↓ | |||
| Neurokemiallinen plastisuus | |||||||
|
CREB fosforylaatio on makaavassa tumakkeessa |
↓ | ↓ | ↓ | ↓ | ↓ | ||
| Herkistettyjä dopamiinin vastaus on makaavassa tumakkeessa |
Ei | Joo | Ei | Joo | |||
| Muutettu striatalin dopamiinin signalointi | ↓ DRD2 , ↑ DRD3 | ↑ DRD1 , ↓ DRD2 , ↑ DRD3 | ↑ DRD1 , ↓ DRD2 , ↑ DRD3 | ↑ DRD2 | ↑ DRD2 | ||
| Muutettu striatalin opioidisignaali | Ei muutoksia tai ↑ μ-opioidireseptoreita |
↑ μ-opioidireseptorit ↑ κ-opioidireseptorit |
↑ μ-opioidireseptorit | ↑ μ-opioidireseptorit | Ei muutosta | Ei muutosta | |
| Muutokset striatalin opioidipeptideissä | ↑ dynorfiini Ei muutosta: enkefaliini |
↑ dynorfiini | ↓ enkefaliini | ↑ dynorfiini | ↑ dynorfiini | ||
| Mesokortikolimbinen synaptinen plastisuus | |||||||
| Lukumäärä dendriittien on makaavassa tumakkeessa | ↓ | ↑ | ↑ | ||||
|
Dendriittiokasten tiheys makaavassa tumakkeessa |
↓ | ↑ | ↑ | ||||
Riippuvuus ja vetäytyminen
Huumeiden sietokyky kehittyy nopeasti amfetamiinin väärinkäytössä (eli amfetamiinin virkistyskäytössä virkistyskäytössä), joten pitkäaikainen väärinkäyttö vaatii yhä suurempia lääkeannoksia saman vaikutuksen saavuttamiseksi. Cochrane-katsauksen mukaan vetäytymisestä henkilöillä, jotka käyttävät pakollisesti amfetamiinia ja metamfetamiinia, "kun krooniset raskaat käyttäjät lopettavat äkillisesti amfetamiinin käytön, monet raportoivat aikarajoitetusta vieroitusoireyhtymästä, joka ilmenee 24 tunnin kuluessa viimeisestä annoksesta." Tässä katsauksessa todettiin, että vieroitusoireet kroonisilla, suuriannoksisilla käyttäjillä ovat yleisiä, niitä esiintyy noin 88 prosentissa tapauksista, ja ne jatkuvat 3-4 viikkoa, ja ensimmäisen viikon aikana esiintyy merkittävä "kaatumisvaihe". Amfetamiinin vieroitusoireita voivat olla ahdistus, lääkkeiden himo , masentunut mieliala , väsymys , lisääntynyt ruokahalu , lisääntynyt liike tai vähentynyt liike , motivaation puute, unettomuus tai uneliaisuus ja kirkkaat unet . Katsaus osoitti, että vieroitusoireiden vakavuus korreloi positiivisesti yksilön iän ja heidän riippuvuutensa kanssa. Lieviä vieroitusoireita amfetamiinihoidon lopettamisesta terapeuttisilla annoksilla voidaan välttää pienentämällä annosta.
Yliannostus
Amfetamiinin yliannostus voi aiheuttaa monia erilaisia oireita, mutta se on harvoin hengenvaarallinen asianmukaisella hoidolla. Yliannostusoireiden vakavuus kasvaa annoksen myötä ja vähenee, kun lääkeaine sietoa amfetamiinille. Siedettävien yksilöiden tiedetään ottavan jopa 5 grammaa amfetamiinia päivässä, mikä on suunnilleen 100 kertaa suurin päivittäinen terapeuttinen annos. Kohtalaisen ja erittäin suuren yliannostuksen oireet on lueteltu alla; kuolemaan johtavaan amfetamiinimyrkytykseen liittyy yleensä myös kouristuksia ja koomaa . Vuonna 2013 amfetamiinin, metamfetamiinin ja muiden " amfetamiinin käyttöhäiriöön " liittyvien yhdisteiden yliannostus johti arviolta 3788 kuolemaan maailmanlaajuisesti ( 3425–4 145 kuolemaa, 95%: n luottamus ).
| Järjestelmä | Pieni tai kohtalainen yliannostus | Vaikea yliannostus |
|---|---|---|
| Sydän ja verisuonisto |
|
|
|
Keskushermoston järjestelmä |
|
|
| Tuki- ja liikuntaelimistö |
|
|
| Hengitys |
|
|
| Virtsatie |
|
|
| Muut |
|
|
Myrkyllisyys
Jyrsijöillä ja kädellisillä riittävän suuret amfetamiiniannokset aiheuttavat dopaminergistä neurotoksisuutta tai vaurioita dopamiinineuroneille, jolle on tunnusomaista dopamiinin terminaalinen rappeutuminen ja vähentynyt kuljettaja- ja reseptoritoiminta. Ei ole näyttöä siitä, että amfetamiini olisi suoraan neurotoksinen ihmisille. Suuret amfetamiiniannokset voivat kuitenkin epäsuorasti aiheuttaa dopaminergistä neurotoksisuutta hyperpyreksian , reaktiivisten happilajien liiallisen muodostumisen ja lisääntyneen dopamiinin autoksidoitumisen seurauksena. Eläinmallit neurotoksisuudesta suuriannoksisesta amfetamiinialtistuksesta osoittavat, että hyperpyreksian esiintyminen (eli kehon ydinlämpötila ≥ 40 ° C) on välttämätön amfetamiinin aiheuttaman neurotoksisuuden kehittymiselle. Pitkäaikainen aivojen lämpötilan nousu yli 40 ° C todennäköisesti edistää amfetamiinin aiheuttaman neurotoksisuuden kehittymistä koe-eläimillä helpottamalla reaktiivisten happilajien tuotantoa, häiritsemällä soluproteiinitoimintaa ja lisäämällä ohimenevästi veri-aivoesteen läpäisevyyttä.
Psykoosi
Amfetamiinin yliannostus voi johtaa piristävään psykoosiin, johon voi liittyä erilaisia oireita, kuten harhaluuloja ja vainoharhaisuutta. Cochrane -katsauksessa amfetamiinin, dekstroamfetamiinin ja metamfetamiinin psykoosin hoidosta todetaan, että noin 5–15% käyttäjistä ei toipu täysin. Saman katsauksen mukaan on olemassa ainakin yksi tutkimus, joka osoittaa, että psykoosilääkkeet ratkaisevat tehokkaasti akuutin amfetamiinipsykoosin oireet. Psykoosi syntyy harvoin terapeuttisesta käytöstä.
Lääkkeiden yhteisvaikutukset
Monien aineiden tiedetään olevan vuorovaikutuksessa amfetamiinin kanssa, mikä johtaa muuttuneeseen lääkkeen toimintaan tai amfetamiinin, vuorovaikutuksessa olevan aineen tai molempien aineenvaihduntaan . Amfetamiinia metaboloivien entsyymien estäjät (esim. CYP2D6 ja FMO3 ) pidentävät sen eliminaation puoliintumisaikaa , mikä tarkoittaa, että sen vaikutukset kestävät pidempään. Amfetamiini on myös vuorovaikutuksessa MAO: n estäjien , erityisesti monoamiinioksidaasi A: n estäjien kanssa, koska sekä MAO: n estäjät että amfetamiini lisäävät plasman katekoliamiinien (eli noradrenaliinin ja dopamiinin) määrää; siksi molempien samanaikainen käyttö on vaarallista. Amfetamiini säätelee useimpien psykoaktiivisten lääkkeiden toimintaa. Erityisesti amfetamiini voi vähentää rauhoittavien ja masennuslääkkeiden vaikutuksia ja lisätä piristeiden ja masennuslääkkeiden vaikutuksia . Amfetamiini voi myös vähentää verenpainelääkkeiden ja psykoosilääkkeiden vaikutuksia, koska se vaikuttaa vastaavasti verenpaineeseen ja dopamiiniin. Sinkin lisäys voi pienentää amfetamiinin minimiannosta , kun sitä käytetään ADHD: n hoitoon.
Yleensä ei ole merkittävää vuorovaikutusta, kun kulutetaan amfetamiinia ruoan kanssa, mutta ruoansulatuskanavan sisällön ja virtsan pH vaikuttaa amfetamiinin imeytymiseen ja erittymiseen . Happamat aineet vähentävät amfetamiinin imeytymistä ja lisäävät virtsan erittymistä, ja emäksiset aineet tekevät päinvastoin. Koska pH: n vaikutuksen imeytymiseen, amfetamiinin myös vuorovaikutuksessa mahahapon alennusvaihteet, kuten protonipumpun estäjät ja H 2 antihistamiinit , jotka lisäävät maha-suolikanavan pH: ta (eli tehdä vähemmän hapan).
Farmakologia
Farmakodynamiikka
|
Amfetamiinin farmakodynamiikka dopamiinin neuronissa
|
Amfetamiini käyttää käyttäytymisvaikutuksiaan muuttamalla monoamiinien käyttöä hermosolusignaaleina aivoissa, pääasiassa katekoliamiinineuroneissa aivojen palkitsemis- ja toimeenpanoväylillä. Palkitsemispiiriin ja toimeenpanotoimintaan liittyvien tärkeimpien välittäjäaineiden, dopamiinin ja norepinefriinin, pitoisuudet lisääntyvät dramaattisesti annosriippuvalla tavalla amfetamiinin vaikutuksesta monoamiinin kuljettajiin . Vahvistaminen ja kannustavia salience -edistää vaikutuksia amfetamiinin johtuvat pääasiassa parantaa dopaminerginen aktiivisuus on mesolimbiseen . Euphoric ja liikuntaelinten-stimuloivia vaikutuksia amfetamiinin riippuvat suuruus ja nopeus, jolla se lisää synaptisen dopamiinin ja noradrenaliinin pitoisuudet striatumissa .
Amfetamiini on tunnistettu voimakas täydellinen agonisti ja jäljittää amiini-kytkentäisen reseptorin 1 (TAAR1), joka on G: n kanssa kytkettyä ja G q kanssa kytkettyä G-proteiiniin kytketty reseptori (GPCR) löydettiin vuonna 2001, joka on tärkeä asetus aivojen monoamiinien . TAAR1: n aktivointi lisää cAMP: n tuotantoa adenylyylisyklaasin aktivoinnin kautta ja estää monoamiinikuljetustoimintoa . Monoamiinioksidaasin autoreseptoreja (esim, D 2 lyhyt , presynaptisen α 2 , ja presynaptisen 5-HT 1A ) on päinvastainen vaikutus TAAR1, ja yhdessä nämä reseptorit tarjoavat sääntely järjestelmä monoamiineja. Erityisesti amfetamiinilla ja jäljitettävillä amiineilla on korkeat sitoutumisaffiniteetit TAAR1: een, mutta ei monoamiiniautoretseptoriin. Kuvantamistutkimukset osoittavat, että amfetamiinin ja jäljitysamiinien monoamiinin takaisinoton esto on paikkaspesifinen ja riippuu TAAR1 -paikannuksen läsnäolosta siihen liittyvissä monoamiini-neuroneissa.
Sen lisäksi, että neuronaalisen monoamiinin kuljettajien , amfetamiini myös estää sekä vesicular monoamiininkuljettaji- , VMAT1 ja VMAT2 , sekä SLC1A1 , SLC22A3 , ja SLC22A5 . SLC1A1 on herättävä aminohappokuljettaja 3 (EAAT3), glutamaattikuljettaja, joka sijaitsee neuroneissa, SLC22A3 on ekstrauronaalinen monoamiinikuljetin, joka on läsnä astrosyyteissä , ja SLC22A5 on korkean affiniteetin karnitiinikuljetin . Amfetamiinin tiedetään indusoivan voimakkaasti kokaiinin ja amfetamiinin säätelemän transkription (CART) geeniekspressiota , neuropeptidiä, joka osallistuu ruokintakäyttäytymiseen, stressiin ja palkitsemiseen, mikä saa aikaan havaittavan lisääntymisen hermosolujen kehityksessä ja selviytymisessä in vitro . CART -reseptoria ei ole vielä tunnistettu, mutta on olemassa merkittäviä todisteita siitä, että CART sitoutuu ainutlaatuiseen G i /G o -kytkettyyn GPCR: ään . Amfetamiini estää myös monoamiinioksidaaseja erittäin suurina annoksina, mikä johtaa vähemmän monoamiini- ja jäljitysamiiniaineenvaihduntaan ja siten korkeampiin synaptisten monoamiinien pitoisuuksiin. Ihmisillä ainoa post-synaptinen reseptori, johon amfetamiinin tiedetään sitoutuvan, on 5-HT1A- reseptori , jossa se toimii agonistina, jolla on alhainen mikromolaarinen affiniteetti.
Koko profiili amfetamiinin lyhyen aikavälin lääkkeen vaikutuksia ihmisellä on yleensä saatu lisäämällä solukkojärjestelmän tai neurotransmissiota ja dopamiinin , serotoniinin , noradrenaliinin , epinefriini , histamiini , OSTOSKORIIN peptidit , endogeeniset opioidit , adrenokortikotropiinihormonin , kortikosteroidit , ja glutamaatti , joka on vaikutuksia läpi vuorovaikutus OSTOSKORIIN , 5-HT1A , EAAT3 , TAAR1 , VMAT1 , VMAT2 , ja mahdollisesti muita biologisia kohteita . Amfetamiini aktivoi myös seitsemän ihmisen hiilihappoanhydraasientsyymiä , joista useita ilmentyy ihmisen aivoissa.
Dekstroamfetamiini on voimakkaampi agonistin TAAR1 kuin levoamfetamiini. Näin ollen dekstroamfetamiini tuottaa enemmän keskushermostoa kuin levoamfetamiini, noin kolme tai neljä kertaa enemmän, mutta levoamfetamiinilla on hieman voimakkaampia sydän- ja perifeerisiä vaikutuksia.
Dopamiini
Tietyillä aivojen alueilla amfetamiini lisää dopamiinin pitoisuutta synaptisessa halkeamassa . Amfetamiini voi päästä presynaptiseen neuroniin joko DAT: n kautta tai diffundoitumalla suoraan hermosolukalvon poikki. DAT -oton seurauksena amfetamiini aiheuttaa kilpailukykyisen takaisinoton esteen kuljettajalla. Tullessaan presynaptiseen neuroniin amfetamiini aktivoi TAAR1: n, joka proteiinikinaasi A: n (PKA) ja proteiinikinaasi C: n (PKC) signaloinnin kautta aiheuttaa DAT -fosforylaation . Fosforylaatiota joko proteiinikinaasin voi johtaa DAT sisäistämisen ( ei-kompetitiivinen takaisinoton inhibition), mutta PKC-välitteisen fosforylaation yksin indusoi käänteinen dopamiinin kuljetuksen kautta DAT (eli dopamiinin ulosvirtaus ). Amfetamiini on myös tiedetään lisäävän solunsisäistä kalsiumia, vaikutus, joka liittyy DAT fosforylaation kautta tunnistamaton Ca2 + / kalmoduliinista riippuvan proteiinikinaasi (CaMK) -riippuvaisen reitin puolestaan tuottavat dopamiinia ulosvirtausta. N suoran aktivoinnin kautta G-proteiiniin kytketty sisäänpäin korjata kaliumkanavien , TAAR1 vähentää tulinopeuteen dopamiinineuronien, estää hyper-dopaminerginen tilassa.
Amfetamiini on myös substraatti presynaptisen vesikulaarisen monoamiinikuljettajan , VMAT2 . Amfetamiinin ottamisen jälkeen VMAT2: ssa amfetamiini aiheuttaa vesikulaarisen pH -gradientin romahtamisen, mikä johtaa dopamiinimolekyylien vapautumiseen synaptisista rakkuloista sytosoliin dopamiinivirtauksen kautta VMAT2: n kautta. Myöhemmin sytosoliset dopamiinimolekyylit vapautuvat presynaptisesta neuronista synaptiseen halkeamaan käänteisen kuljetuksen kautta DAT: llä .
Norepinefriini
Kuten dopamiini, amfetamiini lisää annoksesta riippuen synaptisen norepinefriinin, epinefriinin suoran edeltäjän, tasoa . Neuronaalisen TAAR1 -mRNA: n ilmentymisen perusteella amfetamiinin uskotaan vaikuttavan norepinefriiniin vastaavasti kuin dopamiini. Toisin sanoen, amfetamiini indusoi TAAR1-välitteistä ulosvirtausta ja ei-kilpailevaa takaisinoton estoa fosforyloidussa NET: ssä , kilpailevaa NET: n takaisinoton estoa ja noradrenaliinin vapautumista VMAT2: sta .
Serotoniini
Amfetamiinilla on samankaltaisia, mutta vähemmän voimakkaita vaikutuksia serotoniiniin kuin dopamiiniin ja noradrenaliiniin. Amfetamiini vaikuttaa serotoniiniin VMAT2: n kautta ja noradrenaliinin tavoin sen uskotaan fosforyloivan SERT : ää TAAR1: n kautta . Kuten dopamiinilla, amfetamiinilla on alhainen mikromolaarinen affiniteetti ihmisen 5-HT1A-reseptoriin .
Muut välittäjäaineet, peptidit, hormonit ja entsyymit
| Entsyymi | K A ( nM ) | Lähteet |
|---|---|---|
| hCA4 | 94 | |
| hCA5A | 810 | |
| hCA5B | 2560 | |
| hCA7 | 910 | |
| hCA12 | 640 | |
| hCA13 | 24100 | |
| hCA14 | 9150 |
Akuutti amfetamiinin antaminen ihmisille lisää endogeenistä opioidien vapautumista useissa palkitsemisjärjestelmän aivojen rakenteissa . Aivojen ensisijaisen kiihottavan välittäjäaineen , glutamaatin , solunsisäisten tasojen on osoitettu nousevan striatumissa amfetamiinialtistuksen jälkeen. Tämä solunulkoisen glutamaatin lisääntyminen tapahtuu oletettavasti EAAT3: n , glutamaatin takaisinoton kuljettajan, amfetamiinin aiheuttaman internalisaation kautta dopamiinin neuroneissa. Amfetamiinin aiheuttaa myös selektiivisen vapautumisen histamiinin peräisin syöttösoluista ja ulosvirtausta histaminergisten neuronien kautta VMAT2 . Akuutti amfetamiinin anto voi myös lisätä adrenokortikotrooppisen hormonin ja kortikosteroidien pitoisuuksia veriplasmassa stimuloimalla hypotalamuksen - aivolisäkkeen - lisämunuaisen akselia .
Joulukuussa 2017 julkaistiin ensimmäinen tutkimus, jossa arvioitiin amfetamiinin ja ihmisen hiilihappoanhydraasientsyymien vuorovaikutusta . tutkituista yhdestätoista hiilihappoanhydraasientsyymistä se havaitsi, että amfetamiini aktivoi tehokkaasti seitsemän, joista neljä ilmentyy voimakkaasti ihmisen aivoissa , ja niillä on alhainen nanomolaarisuus matalan mikromolaarisen aktivoivan vaikutuksen kautta. Prekliinisiin tutkimuksiin perustuen aivojen hiilihappoanhydraasin aktivaatiolla on kognitiota parantavia vaikutuksia; mutta hiilihappoanhydraasin estäjien kliinisen käytön perusteella hiilihappoanhydraasin aktivaatio muissa kudoksissa voi liittyä haittavaikutuksiin, kuten silmän aktivoitumiseen, joka pahentaa glaukoomaa .
Farmakokinetiikka
Amfetamiinin biologinen hyötyosuus suun kautta vaihtelee ruoansulatuskanavan pH: n mukaan; se imeytyy suolistosta hyvin, ja dekstroamfetamiinin hyötyosuus on tyypillisesti yli 75%. Amfetamiini on heikko emäs, jossa on p K 9,9; näin ollen, kun pH on emäksinen, niin lisää lääkeainetta on sen rasva liukoinen vapaan emäksen muodossa, ja lisää imeytyy runsaasti lipidejä sisältävää solukalvojen suolen epiteelin . Sitä vastoin hapan pH tarkoittaa, että lääke on pääasiassa vesiliukoisessa kationisessa (suolan) muodossa ja vähemmän imeytyy. Noin 20% verenkierrossa kiertävästä amfetamiinista sitoutuu plasman proteiineihin . Imeytymisen jälkeen amfetamiini jakautuu helposti useimpiin kehon kudoksiin ja suuria pitoisuuksia esiintyy aivo -selkäydinnesteessä ja aivokudoksessa .
Puoli-elämään amfetamiinin eroavatko enantiomeerit ja vaihtelevat virtsan pH. Normaalissa virtsan pH: ssa dekstroamfetamiinin ja levoamfetamiinin puoliintumisajat ovat vastaavasti 9–11 tuntia ja 11–14 tuntia. Erittäin hapan virtsa lyhentää enantiomeerin puoliintumisajat 7 tuntiin; erittäin emäksinen virtsa lisää puoliintumisaikoja jopa 34 tuntiin. Molempien isomeerien suolan välittömän vapautumisen ja pitkävaikutteiset variantit saavuttavat huippupitoisuudet plasmassa 3 tuntia ja 7 tuntia annoksen jälkeen. Amfetamiini eliminoituu munuaisten kautta , ja 30–40% lääkkeestä erittyy muuttumattomana virtsan normaalissa pH: ssa. Kun virtsan pH on emäksinen, amfetamiini on vapaan emäksen muodossa, joten sitä erittyy vähemmän. Kun virtsan pH on epänormaali, amfetamiinin talteenotto virtsassa voi vaihdella 1%: sta 75%: iin, riippuen siitä, onko virtsa liian emäksistä vai hapanta. Oraalisen annon jälkeen amfetamiini ilmestyy virtsaan 3 tunnin kuluessa. Noin 90% nautitusta amfetamiinista eliminoituu 3 päivää viimeisen suun kautta otetun annoksen jälkeen.
Aihiolääke lisdeksamfetamiini ei ole niin herkkä pH: lle kuin amfetamiini, kun se imeytyy ruoansulatuskanavaan; absorption jälkeen verenkiertoon, se muunnetaan punasolujen -associated entsyymejä ja dekstroamfetamiini kautta hydrolyysin . Lisdeksamfetamiinin eliminaation puoliintumisaika on yleensä alle 1 tunti.
CYP2D6: n , dopamiinin β-hydroksylaasin (DBH), flaviinin mono-oksygenaasin 3 (FMO3), butyraatti-CoA-ligaasi (XM-ligaasi), ja glysiiniksi N -acyltransferase (GLYAT) ovat entsyymejä, joiden tiedetään aineenvaihdunta amfetamiini tai sen metaboliittien ihmisillä. Amfetamiini on erilaisia erittyy aineenvaihduntatuotteita, mukaan lukien 4-hydroksiamfetamiini , 4-hydroxynorephedrine , 4-hydroxyphenylacetone , bentsoehappo , hippuurihappo , norefedriini , ja fenyyliasetoni . Näistä metaboliiteista aktiivisia sympatomimeetteja ovat 4-hydroksiamfetamiini , 4- hydroksynorefedriini ja norefedriini. Päämetaboliareittiä ratoihin kuuluu aromaattinen para-hydroksylaation, alifaattisten alfa- ja beeta-hydroksylaatio, N -oksidaatio, N -dealkylation, ja deaminaation. Tunnettuja metabolisia reittejä, havaittavia metaboliitteja ja metaboloivia entsyymejä ihmisissä ovat seuraavat:
|
Amfetamiinin metaboliareitit ihmisillä
|
Farmakokrobiomiikka
Ihmisen metagenome (eli geneettinen koostumus yksilön ja kaikki mikro-organismit, jotka sijaitsevat tai yksittäisissä kehon) vaihtelee huomattavasti yksilöiden välillä. Koska kokonaismäärä mikrobien ja virusten solut ihmiskehossa (yli 100000000000000) suuresti outnumbers ihmisen soluja (kymmeniä miljardeja), on huomattavaa potentiaalia vuorovaikutuksia lääkeaineiden ja yksilön microbiome, mukaan lukien: lääkkeet muuttamalla koostumusta ihmisen mikrobiomi , lääkkeiden aineenvaihdunta mikrobi -entsyymien avulla, jotka muuttavat lääkkeen farmakokineettistä profiilia, ja mikrobien lääkeaineenvaihdunta, joka vaikuttaa lääkkeen kliiniseen tehoon ja toksisuusprofiiliin . Näitä vuorovaikutuksia tutkiva kenttä tunnetaan farmakokrobiomina .
Kuten useimmat biomolekyylit ja muut suun kautta otettavat ksenobiootit (eli lääkkeet), myös amfetamiinin ennustetaan tapahtuvan epävakaassa aineenvaihdunnassa ihmisen ruoansulatuskanavan mikrobiston (ensisijaisesti bakteerien) kautta ennen imeytymistä verenkiertoon . Ensimmäinen amfetamiinia metaboloiva mikrobi-entsyymi, tyramiinioksidaasi E. coli -kannasta, joka tavallisesti esiintyy ihmisen suolistossa, tunnistettiin vuonna 2019. Tämän entsyymin havaittiin metaboloivan amfetamiinia, tyramiinia ja fenetyyliamiinia suunnilleen samalla sitoutumisaffiniteetilla kaikkiin kolmeen yhdisteet.
Samankaltaisia endogeenisiä yhdisteitä
Amfetamiini on rakenteeltaan ja toiminnaltaan hyvin samankaltainen kuin endogeeniset jäljitysamiinit, jotka ovat luonnossa esiintyviä ihmiskehossa ja aivoissa tuotettuja neuromodulaattorimolekyylejä . Tästä ryhmästä lähimpiä yhdisteitä ovat fenetyyliamiini , amfetamiinin lähtöyhdiste ja N -metyylifenetyyliamiini , amfetamiinin isomeeri (eli sillä on sama molekyylikaava). Ihmisillä, fenetyyliamiini on tuotettu suoraan L-fenyylialaniini , että aromaattisten aminohappojen dekarboksylaasin (AADC) entsyymi, joka muuntaa L-DOPA dopamiiniksi samoin. N -metyylifenetyyliamiini puolestaan metaboloituu fenetyyliamiinista fenyylietanoliamiinin N -metyylitransferaasin kautta , sama entsyymi, joka metaboloi noradrenaliinin epinefriiniksi. Amfetamiinin tavoin sekä fenetyyliamiini että N -metyylifenetyyliamiini säätelevät monoamiinin neurotransmissiota TAAR1: n kautta ; toisin kuin amfetamiini, nämä molemmat aineet hajoavat monoamiinioksidaasi B: llä , ja siksi niiden puoliintumisaika on lyhyempi kuin amfetamiinilla.
Kemia
|
Raseeminen amfetamiini
|
Fenyyli-2-nitropropeeni (oikea kuppi)
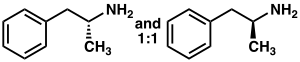
Amfetamiini on metyyli homologi nisäkkään välittäjäaine fenetyyliamiini kemiallinen kaava C 9 H 13 N. Ensisijaisen amiinin vieressä oleva hiiliatomi on stereogeeninen keskus , ja amfetamiini koostuu kahden enantiomeerin raseemisesta 1: 1 -seoksesta . Tämä raseeminen seos voidaan erottaa sen optisiksi isomeereiksi: levoamfetamiiniksi ja dekstroamfetamiiniksi . Huoneenlämpötilassa amfetamiinin puhdas vapaa emäs on liikkuva, väritön ja haihtuva neste, jolla on tyypillisesti voimakas amiinin haju ja kirpeä, palava maku. Usein valmistettuja kiinteitä amfetamiinisuoloja ovat amfetamiiniadipaatti, aspartaatti, hydrokloridi, fosfaatti, sakkarinaatti, sulfaatti ja tannaatti. Dekstroamfetamiinisulfaatti on yleisin enantiopure -suola. Amfetamiini on myös oman rakenteellisen luokkansa emoyhdiste , joka sisältää useita psykoaktiivisia johdannaisia . Orgaanisen kemian, amfetamiini on erinomainen kiraalinen ligandi varten stereoselektiivinen synteesi on 1,1'-bi-2-naftolia .
Korvatut johdannaiset
Amfetamiinin substituoidut johdannaiset tai "substituoidut amfetamiinit" ovat laaja valikoima kemikaaleja, jotka sisältävät "selkärangan" amfetamiinia; erityisesti tämä kemikaaliluokka sisältää johdannaisyhdisteet , jotka muodostuvat korvaamalla yksi tai useampi vetyatomi amfetamiiniydinrakenteessa substituenteilla . Luokkaan kuuluvat muun muassa amfetamiini, stimulantit, kuten metamfetamiini, serotonergiset empatogeenit, kuten MDMA , ja dekongestantit, kuten efedriini .
Synteesi
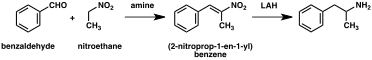
Koska ensimmäinen valmiste raportoitiin vuonna 1887, on kehitetty lukuisia synteettisiä reittejä amfetamiiniin. Yleisin laillisen ja laittoman amfetamiinisynteesin reitti käyttää ei-metallipelkistystä, joka tunnetaan Leuckart-reaktiona (menetelmä 1). Ensimmäisessä vaiheessa reaktio fenyyliasetonin ja formamidin välillä , joko käyttämällä lisämuurahaishappoa tai formamidia itse pelkistävänä aineena, tuottaa N -formyyliamfetamiinia . Tämä välituote hydrolysoidaan sitten suolahapolla ja sitten tehdään emäksiseksi, uutetaan orgaanisella liuottimella, väkevöidään ja tislataan, jolloin saadaan vapaa emäs. Vapaa emäs liuotetaan sitten orgaaniseen liuottimeen, lisätään rikkihappoa ja amfetamiini saostuu sulfaattisuolana.
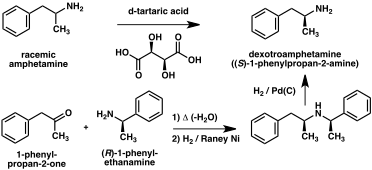
Amfetamiinin kahden enantiomeerin erottamiseksi on kehitetty useita kiraalisia päätöslauselmia . Esimerkiksi raseemista amfetamiinia voidaan käsitellä d- viinihapolla diastereoisomeerisen suolan muodostamiseksi, joka kiteytetään fraktioituna , jolloin saadaan dekstroamfetamiinia. Kiraalinen resoluutio on edelleen taloudellisin tapa saada optisesti puhdasta amfetamiinia suuressa mittakaavassa. Lisäksi on kehitetty useita amfetamiinin enantioselektiivisiä synteesejä. Yhdessä esimerkissä optisesti puhdas ( R ) -1-fenyylietaaniamiini kondensoidaan fenyyliasetonin kanssa, jolloin saadaan kiraalinen Schiff-emäs . Avainvaiheessa tämä välituote pelkistetään katalyyttisellä hydrauksella siirtämällä kiraalisuus hiiliatomiin alfa aminoryhmään. Bentsyyliamiinisidoksen katkaiseminen hydrauksella tuottaa optisesti puhdasta dekstroamfetamiinia.
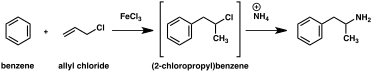
Suuri määrä vaihtoehtoisia synteettisiä reittejä amfetamiinille on kehitetty klassisten orgaanisten reaktioiden perusteella. Yksi esimerkki on Friedel-Crafts- alkylointi bentseenin mukaan allyylikloridin , jolloin saatiin beeta chloropropylbenzene joka saatetaan sitten reagoimaan ammoniakin kanssa raseemisen amfetamiinin (menetelmä 2). Toinen esimerkki käyttää Ritter -reaktiota (menetelmä 3). Tällä tavalla allyylibentseenin annetaan reagoida asetonitriilin kanssa rikkihapossa, jolloin saadaan organosulfaatti, joka puolestaan käsitellään natriumhydroksidilla, jolloin saadaan amfetamiinia asetamidivälituotteen kautta . Kolmas reitti alkaa etyyli-3-oksobutanoaatilla, joka kaksinkertaisella alkyloinnilla metyylijodidilla ja sen jälkeen bentsyylikloridilla voidaan muuttaa 2-metyyli-3-fenyylipropaanihapoksi . Tämä synteettinen välituote voidaan muuntaa amfetamiiniksi joko Hofmann- tai Curtius -uudelleenjärjestelyllä (menetelmä 4).
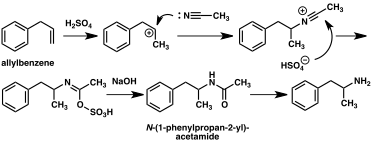
Merkittävässä määrässä amfetamiinisynteesejä on nitro- , imiini- , oksiimi- tai muiden typpeä sisältävien funktionaalisten ryhmien pelkistys . Eräässä tällaisessa esimerkissä Knoevenagel- kondensaatio on bentsaldehydin kanssa nitroetaanin tuottaa fenyyli-2-nitropropene . Tämän välituotteen kaksoissidos ja nitroryhmä pelkistetään joko katalyyttisellä hydrauksella tai käsittelemällä litiumalumiinihydridillä (menetelmä 5). Toinen menetelmä on fenyyliasetonin reaktio ammoniakin kanssa , jolloin saadaan imiinivälituote, joka pelkistetään primääriseksi amiiniksi käyttäen vetyä palladiumkatalyytin tai litiumalumiinihydridin päällä (menetelmä 6).
|
|
|
Havaitseminen kehon nesteissä
Amfetamiinia mitataan usein virtsasta tai verestä osana urheilua, työllisyyttä, myrkytysdiagnostiikkaa ja rikostekniikkaa koskevaa huumetestiä . Tekniikat, kuten immunomääritys , joka on yleisin amfetamiinitestin muoto, voivat ristireagoida useiden sympatomimeettisten lääkkeiden kanssa. Amfetamiinille ominaisia kromatografisia menetelmiä käytetään väärien positiivisten tulosten estämiseksi. Kiraalisia erotustekniikoita voidaan käyttää auttamaan erottamaan lääkkeen lähde, olivatpa ne reseptilääkkeitä amfetamiinia, reseptilääkkeitä amfetamiinia (esim. Selegiliinia ), levometamfetamiinia sisältäviä käsikauppalääkkeitä tai laittomasti hankittuja korvattuja amfetamiineja. Useita reseptilääkkeiden tuottavat amfetamiinia kuin aineenvaihduntatuote , kuten bentsfetamiini , klobentsoreksi , famprofazone , fenproporexia , lisdeksamfetamiini , mesocarb , metamfetamiini, prenyyliamiini ja selegiliini mm. Nämä yhdisteet voivat tuottaa positiivisia tuloksia amfetamiinille huumetestissä. Amfetamiini on yleensä havaittavissa vain tavanomaisella huumetestillä noin 24 tunnin ajan, vaikka suuri annos voi olla havaittavissa 2–4 päivän ajan.
Määrityksiä varten tutkimuksessa todettiin, että entsyymin moninkertainen immuunimääritystekniikka (EMIT) -määritys amfetamiinille ja metamfetamiinille voi tuottaa enemmän vääriä positiivisia tuloksia kuin nestekromatografia - tandem -massaspektrometria . Amfetamiinin ja metamfetamiinin kaasukromatografia-massaspektrometria (GC-MS) johdannaisen ( S )-(-)-trifluoriasetyylipolylykloridin kanssa mahdollistaa metamfetamiinin havaitsemisen virtsassa. Amfetamiinin ja metamfetamiinin GC -MS yhdessä kiraalisen johdannaisen kanssa Mosherin happokloridi mahdollistaa sekä dekstroamfetamiinin että dekstrometamfetamiinin havaitsemisen virtsassa. Näin ollen jälkimmäistä menetelmää voidaan käyttää näytteissä, jotka antavat positiivisen tuloksen käyttämällä muita menetelmiä lääkkeen eri lähteiden erottamiseksi toisistaan.
Historia, yhteiskunta ja kulttuuri
| Aine | Paras arvio |
Alhainen arvio |
Korkea arvio |
|---|---|---|---|
| Amfetamiinityyppisiä piristeitä |
34.16 | 13.42 | 55.24 |
| Kannabista | 192,15 | 165,76 | 234,06 |
| Kokaiini | 18.20 | 13.87 | 22,85 |
| Ekstaasi | 20.57 | 8,99 | 32,34 |
| Opiaatit | 19.38 | 13.80 | 26.15 |
| Opioidit | 34.26 | 27.01 | 44,54 |
Amfetamiinin syntetisoi ensimmäisen kerran vuonna 1887 Saksassa romanialainen kemisti Lazăr Edeleanu, joka antoi sille nimen fenyyli -isopropyyliamiini ; sen stimulanttivaikutukset pysyivät tuntemattomina vuoteen 1927 asti, jolloin Gordon Alles syntetisoi sen itsenäisesti ja ilmoitti olevan sympatomimeettisiä ominaisuuksia. Amfetamiinilla ei ollut lääketieteellistä käyttöä vasta vuoden 1933 lopulla, jolloin Smith, Kline ja French alkoivat myydä sitä inhalaattorina tuotenimellä Benzedrine dekongestanttina. Benzedriinisulfaatti otettiin käyttöön 3 vuotta myöhemmin, ja sitä käytettiin monenlaisten sairauksien hoitoon , mukaan lukien narkolepsia , liikalihavuus , matala verenpaine , matala libido ja krooninen kipu . Toisen maailmansodan aikana sekä liittoutuneiden että akselin joukot käyttivät laajalti amfetamiinia ja metamfetamiinia stimuloivien ja suorituskykyä parantavien vaikutustensa vuoksi. Kun huumeiden riippuvuutta aiheuttavat ominaisuudet tulivat tunnetuksi, hallitukset alkoivat valvoa tiukasti amfetamiinin myyntiä. Esimerkiksi Yhdysvalloissa 1970 -luvun alussa amfetamiinista tuli valvottavia aineita koskevan lain mukaan aikataulun II mukainen valvottava aine . Huolimatta hallituksen tiukasta valvonnasta, amfetamiinia ovat käyttäneet laillisesti tai laittomasti ihmiset eri taustoista, kuten kirjoittajat, muusikot, matemaatikot ja urheilijat.
Amfetamiinia syntetisoidaan edelleen laittomasti salaisissa laboratorioissa ja myydään pimeillä markkinoilla , pääasiassa Euroopan maissa. Euroopan unionin (EU) jäsenvaltioista vuonna 2018 11,9 miljoonaa 15–64 -vuotiasta aikuista on käyttänyt amfetamiinia tai metamfetamiinia vähintään kerran elämässään ja 1,7 miljoonaa on käyttänyt joko viimeisen vuoden aikana. Vuoden 2012 aikana EU: n jäsenvaltioissa takavarikoitiin noin 5,9 tonnia laitonta amfetamiinia. laittoman amfetamiinin "katuhinta" EU: ssa vaihteli 6–38 eurosta grammalta saman ajanjakson aikana. Euroopan ulkopuolella amfetamiinin laittomat markkinat ovat paljon pienemmät kuin metamfetamiinin ja MDMA: n markkinat.
Oikeudellinen asema
Seurauksena on YK 1971 psykotrooppisia aineita koskevan yleissopimuksen , amfetamiini tuli kaavio II valvottavan aineen, kuten on määritelty perustamissopimuksessa, kaikissa 183 tilassa osapuolille. Siksi sitä säännellään voimakkaasti useimmissa maissa. Jotkut maat, kuten Etelä -Korea ja Japani, ovat kieltäneet korvaavat amfetamiinit jopa lääketieteelliseen käyttöön. Muissa maissa, kuten Kanadassa ( aikataulu I huume ), Alankomaissa ( luettelo I lääke ), Yhdysvalloissa ( aikataulu II huume ), Australiassa ( aikataulu 8 ), Thaimaassa ( kategoria 1 huumausaine ) ja Yhdistyneessä kuningaskunnassa ( luokan B huume) ), amfetamiini on rajoitetussa kansallisessa huumeaikataulussa, joka sallii sen käytön lääkkeenä.
Farmaseuttiset tuotteet
Useat tällä hetkellä markkinoilla olevat amfetamiinivalmisteet sisältävät molemmat enantiomeerit, mukaan lukien ne, joita markkinoidaan tuotenimillä Adderall, Adderall XR, Mydayis, Adzenys ER, Adzenys XR-ODT , Dyanavel XR, Evekeo ja Evekeo ODT. Näistä Evekeo (mukaan lukien Evekeo ODT) on ainoa tuote, joka sisältää vain raseemista amfetamiinia (amfetamiinisulfaattina), ja siksi se on ainoa, jonka aktiivista osaa voidaan tarkasti kutsua yksinkertaisesti "amfetamiiniksi". Dekstroamfetamiini, jota markkinoidaan tuotenimillä Dexedrine ja Zenzedi, on ainoa tällä hetkellä saatavilla oleva enantiopuhdas amfetamiinituote. Aihiolääke muoto dekstroamfetamiinin, lisdeksamfetamiini , on myös saatavilla ja markkinoidaan tuotemerkillä Vyvanse. Koska lisdeksamfetamiini on aihiolääke, se eroaa rakenteellisesti dekstroamfetamiinista ja on inaktiivinen, kunnes se metaboloituu dekstroamfetamiiniksi. Raseemisen amfetamiinin vapaa emäs oli aiemmin saatavilla nimellä Benzedrine, Psychedrine ja Sympatedrine. Levoamfetamiinia oli aiemmin saatavilla nimellä Cydril. Monet nykyiset amfetamiinilääkkeet ovat suoloja vapaan emäksen suhteellisen suuren haihtuvuuden vuoksi. Kuitenkin suun kautta suspensio ja oraalisesti hajoava tabletti (ODT) annosmuodot muodostuu vapaata emästä otettiin käyttöön vuonna 2015 ja 2016, vastaavasti. Jotkut nykyisistä tuotemerkeistä ja niiden vastaavista tuotteista on lueteltu alla.
| Merkki nimi |
Yhdysvallat Hyväksytty nimi |
(D: L) suhde |
annostus muodossa |
Markkinoinnin aloituspäivä |
Yhdysvaltain kuluttajien hintatiedot |
Lähteet |
|---|---|---|---|---|---|---|
| Adderall | - | 3: 1 (suolat) | tabletti | 1996 | GoodRx | |
| Adderall XR | - | 3: 1 (suolat) | kapseli | 2001 | GoodRx | |
| Mydayis | - | 3: 1 (suolat) | kapseli | 2017 | GoodRx | |
| Adzenys ER | amfetamiini | 3: 1 (pohja) | jousitus | 2017 | GoodRx | |
| Adzenys XR-ODT | amfetamiini | 3: 1 (pohja) | ODT | 2016 | GoodRx | |
| Dyanavel XR | amfetamiini | 3.2: 1 (pohja) | jousitus | 2015 | GoodRx | |
| Evekeo | amfetamiinisulfaatti | 1: 1 (suolat) | tabletti | 2012 | GoodRx | |
| Evekeo ODT | amfetamiinisulfaatti | 1: 1 (suolat) | ODT | 2019 | GoodRx | |
| Dexedrine | dekstroamfetamiinisulfaatti | 1: 0 (suolat) | kapseli | 1976 | GoodRx | |
| Zenzedi | dekstroamfetamiinisulfaatti | 1: 0 (suolat) | tabletti | 2013 | GoodRx | |
| Vyvanse | lisdeksamfetamiinidimesylaatti | 1: 0 (aihiolääke) | kapseli | 2007 | GoodRx | |
| tabletti |
| huume | kaava |
molekyylimassa |
amfetamiinipohja |
amfetamiiniemästä yhtä suurina annoksina |
annosten yhtä emäksen sisältöä |
|||||
|---|---|---|---|---|---|---|---|---|---|---|
| (g/mol) | (prosenttia) | (30 mg: n annos) | ||||||||
| kaikki yhteensä | pohja | kaikki yhteensä | dekstro- | levo- | dekstro- | levo- | ||||
| dekstroamfetamiinisulfaatti | (C 9 H 13 N) 2 • H 2 SO 4 |
368,49
|
270,41
|
73,38%
|
73,38%
|
-
|
22,0 mg
|
-
|
30,0 mg
|
|
| amfetamiinisulfaatti | (C 9 H 13 N) 2 • H 2 SO 4 |
368,49
|
270,41
|
73,38%
|
36,69%
|
36,69%
|
11,0 mg
|
11,0 mg
|
30,0 mg
|
|
| Adderall |
62,57%
|
47,49%
|
15,08%
|
14,2 mg
|
4,5 mg
|
35,2 mg
|
||||
| 25% | dekstroamfetamiinisulfaatti | (C 9 H 13 N) 2 • H 2 SO 4 |
368,49
|
270,41
|
73,38%
|
73,38%
|
-
|
|||
| 25% | amfetamiinisulfaatti | (C 9 H 13 N) 2 • H 2 SO 4 |
368,49
|
270,41
|
73,38%
|
36,69%
|
36,69%
|
|||
| 25% | dekstroamfetamiinisakraatti | (C 9 H 13 N) 2 • C 6 H 10 O 8 |
480,55
|
270,41
|
56,27%
|
56,27%
|
-
|
|||
| 25% | amfetamiiniaspartaattimonohydraatti | (C 9 H 13 N) • C 4 H 7 NO 4 • H 2 O |
286,32
|
135,21
|
47,22%
|
23,61%
|
23,61%
|
|||
| lisdeksamfetamiinidimesylaatti | C 15 H 25 N 3 O • (CH 4 O 3 S) 2 |
455,49
|
135,21
|
29,68%
|
29,68%
|
-
|
8,9 mg
|
-
|
74,2 mg
|
|
| amfetamiinipohjainen suspensio | C 9 H 13 N |
135,21
|
135,21
|
100%
|
76,19%
|
23,81%
|
22,9 mg
|
7,1 mg
|
22,0 mg
|
|
Huomautuksia
- Kuvan legenda
Viitetiedot
Viitteet
Ulkoiset linkit
- "Amfetamiini" . Huumeiden tietoportaali . Yhdysvaltain kansallinen lääketieteen kirjasto.
- CID 5826 , PubChem - dekstroamfetamiini
- CID 32893 , PubChem - Levoamphetamine
- Vertaileva Toxicgenomics -tietokanta: Amfetamiini
- Vertaileva Toxicgenomics -tietokannan merkintä: CARTPT