Isomeeri - Isomer
In kemia , isomeerit ovat molekyylejä tai moniarvoisia ioneja , joilla on identtiset molekyylikaavat - eli sama määrä atomeja kunkin elementin - mutta eri järjestelyistä atomien avaruudellisen. Isomerismi on isomeerien olemassaolo tai mahdollisuus.
Isomeereillä ei välttämättä ole samanlaisia kemiallisia tai fysikaalisia ominaisuuksia . Kaksi isomerismin pääasiallista muotoa ovat rakenteellinen tai perustuslaillinen isomerismi, jossa atomien väliset sidokset eroavat toisistaan; ja stereoisomerismi tai spatiaalinen isomerismi, jossa sidokset ovat samat, mutta atomien suhteelliset sijainnit eroavat toisistaan.
Isomeeriset suhteet muodostavat hierarkian. Kaksi kemikaalia voi olla sama perustuslaillinen isomeeri, mutta syvemmän analyysin perusteella ne voivat olla toistensa stereoisomeerejä. Kaksi molekyyliä, jotka ovat sama stereoisomeeri kuin toiset, voivat olla eri konformaatiomuodoissa tai eri isotopologeja. Analyysin syvyys riippuu tutkimusalueesta tai kiinnostavista kemiallisista ja fysikaalisista ominaisuuksista.
Englanti sana "isomeeri" ( / aɪ s əm ər / ) on back-muodostelman päässä "isomeerinen", joka on lainattu läpi Saksan isomerisch päässä Swedish isomerisk ; joka puolestaan keksittiin kohteesta Greek ἰσόμερoς isómeros , juuret ISOs = "yhtä", Meros = "osa".
Rakenteelliset isomeerit
Rakenteellisissa isomeereissä on sama määrä atomeja kustakin alkuaineesta (siis sama molekyylikaava ), mutta atomit on kytketty eri tavoin.
Esimerkki: C.
3H
8O
Esimerkiksi molekyylikaavalla on kolme erillistä yhdistettä :
Kaksi ensimmäistä esitettyä isomeeriä ovat propanolit , eli propaanista johdetut alkoholit . Molemmilla on ketjun kolme hiiliatomia on kytketty yksinkertaisilla sidoksilla, ja loput hiilen valenssit täytetään seitsemän vety- atomia ja jonka hydroksyyliryhmä ryhmän , joka sisältää happi- atomin, joka on sidottu vetyatomi. Nämä kaksi isomeeriä eroavat siitä, mihin hiileen hydroksyyli sitoutuu: joko hiiliketjun propan-1-oli (1-propanoli, n- propyylialkoholi, n- propanoli; I ) tai äärimmäinen hiili- propaani-2 -ol (2-propanoli, isopropyylialkoholi, isopropanoli; II ). Nämä voidaan kuvata tiivistetyillä rakennekaavoilla ja .
Kolmas isomeeri on eetteri metoksietaanin (etyyli-metyyli-eetteri, III ). Toisin kuin kaksi muuta, siinä on happiatomi kytketty kahteen hiileen ja kaikki kahdeksan vetyä on sitoutunut suoraan hiiliin. Se voidaan kuvata tiivistetyllä kaavalla .
Alkoholi "3-propanoli" ei ole toinen isomeeri, koska sen ja 1-propanolin välinen ero ei ole todellinen; se on vain seurausta mielivaltaisesta valinnasta hiilien järjestyksessä pitkin ketjua. Samasta syystä "etoksimetaani" ei ole toinen isomeeri.
1-propanoli ja 2-propanoli ovat esimerkkejä paikallisista isomeereistä , jotka eroavat toisistaan sen aseman mukaan, jossa tiettyjä piirteitä, kuten kaksoissidoksia tai funktionaalisia ryhmiä , esiintyy "emo" -molekyylillä (propaani siinä tapauksessa).
Esimerkki: C.
3H
4
Hiilivedyn rakenteellisia isomeerejä on myös kolme :
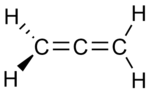
|
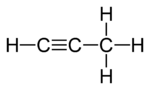
|

|
| I propadieeni | II Propyne | III Syklopropeeni |
Kahdessa isomeeristä kolme hiiliatomia on kytketty avoimeen ketjuun, mutta yhdessä niistä ( propadieeni tai alleeni; I ) hiili on kytketty kahdella kaksoissidoksella , kun taas toisessa ( propyni tai metyyliasetyleeni, II ) ne on yhdistetty yksinkertaisella sidoksella ja kolmoissidoksella . Kolmannessa isomeerissä ( syklopropeeni ; III ) kolme hiiltä on yhdistetty renkaaseen kahdella yksittäisellä sidoksella ja kaksoissidoksella. Kaikissa kolmessa neljä vetyä tyydyttävät hiiliatomien jäljellä olevat valenssit.
Huomaa jälleen, että on vain yksi rakenteellinen isomeeri, jolla on kolmoissidos, koska tämän sidoksen toinen mahdollinen sijoittaminen vain vetää kolme hiiltä eri järjestyksessä. Samasta syystä on vain yksi syklopropeeni, ei kolme.
Tautomeerit
Tautomeerit ovat rakenteellisia isomeerejä, jotka helposti muuttuvat keskenään, joten kaksi tai useampia lajeja esiintyy tasapainossa, kuten
.
Tärkeitä esimerkkejä ovat keto-enolien tautomerismi ja tasapaino aminohapon neutraalien ja kahtaisionisten muotojen välillä .
Resonanssimuodot
Joidenkin molekyylien rakennetta kuvataan joskus resonanssina useiden ilmeisesti erilaisten rakenteellisten isomeerien välillä. Klassinen esimerkki on 1,2 -metyylibentseeni ( o -ksyleeni), jota kuvataan usein kahden ilmeisesti erillisen rakenteellisen isomeerin seoksena:

|
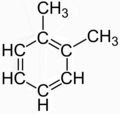
|
Kumpikaan näistä kahdesta rakenteesta ei kuitenkaan kuvaa todellista yhdistettä; ne ovat fictions kehitetty tapa kuvata (niiden "keskiarvon" tai "resonanssi") todellinen delokalisoituneen sidoksen ja o -ksyleeniä, joka on yksittäinen isomeeri , jolla on bentseenin ydin ja kahdella metyyliryhmällä vierekkäisissä asemissa.
Stereoisomeerit
Stereoisomeereillä on samat atomit tai isotoopit, jotka on kytketty samantyyppisillä sidoksilla, mutta ne eroavat toisistaan muodoltaan - näiden atomien suhteelliset sijainnit avaruudessa, lukuun ottamatta kiertoja ja käännöksiä
Teoriassa voidaan kuvitella, että mikä tahansa molekyylin tai ionin atomien avaruusjärjestely muutetaan vähitellen mihin tahansa muuhun järjestelyyn äärettömän monella tavalla siirtämällä jokaista atomia sopivaa polkua pitkin. Kuitenkin atomien sijaintien muutokset muuttavat yleensä molekyylin sisäistä energiaa , joka määräytyy kunkin atomin sidosten välisen kulman ja atomien välisen etäisyyden mukaan (riippumatta siitä, ovatko ne sitoutuneet vai eivät).
Konformaatioisomeerin on järjestely atomien molekyylin tai ionin, jossa sisäinen energia on paikallinen minimi ; toisin sanoen järjestely siten, että pienet muutokset atomien asemissa lisäävät sisäistä energiaa ja johtavat siten voimiin, jotka pyrkivät työntämään atomit takaisin alkuperäisiin asentoihinsa. Molekyylin muodon muuttaminen tällaisesta energiaminimistä toiseen energiaminimiin edellyttää siksi kokoonpanojen läpikäymistä, joissa on korkeampi energia kuin ja . Toisin sanoen konformaatioisomeeri erotetaan muista isomeereistä energiaesteen avulla : määrä, joka on väliaikaisesti lisättävä molekyylin sisäiseen energiaan, jotta kaikki välimuodot voidaan käydä läpi "helpointa" polkua (joka minimoi sen määrän).
Klassinen esimerkki konformaatioisomerismista on sykloheksaani . Alkaanit ovat yleensä vähimmäisenergiaa, kun kulmat ovat lähellä 110 astetta. Sykloheksaanimolekyylin muodoissa, joissa on kaikki kuusi hiiliatomia samassa tasossa, on suurempi energia, koska joidenkin tai kaikkien kulmien on oltava kaukana tästä arvosta (120 astetta normaalille kuusikulmalle). Näin ollen konformaatioissa, jotka ovat paikallisia energiaminimejä, rengas on kierretty avaruuteen yhden kahdesta kuvasta, joka tunnetaan nimellä tuoli (hiilen ollessa vuorotellen keskitason ylä- ja alapuolella) ja vene (kaksi vastakkaista hiiltä tason yläpuolella ja toinen) neljä sen alapuolella).
Jos kahden konformaation isomeerin välinen energiaeste on riittävän alhainen, se voidaan voittaa satunnaisilla lämpöenergian syöttöillä , jotka molekyyli saa vuorovaikutuksesta ympäristön kanssa tai omasta värähtelystään . Siinä tapauksessa kahta isomeeriä voidaan yhtä hyvin pitää yhtenä isomeerinä lämpötilasta ja kontekstista riippuen. Esimerkiksi sykloheksaanin kaksi konformaatiota muuttuvat toisiksi varsin nopeasti huoneenlämpötilassa (nestemäisessä tilassa), joten niitä käsitellään yleensä kemiassa yksittäisenä isomeerinä.
Joissakin tapauksissa este voidaan ylittää atomien kvanttitunnelilla . Tämä viimeinen ilmiö estää fluoriklooriamiinin tai vetyperoksidin stereoisomeerien erottamisen , koska nämä kaksi vähitenergistä konformaatiota muuttuvat muutamassa pikosekunnissa jopa erittäin alhaisissa lämpötiloissa.
Päinvastoin, energiaeste voi olla niin korkea, että helpoin tapa voittaa se vaatisi tilapäisen katkaisun ja sitten uudistamisen tai molekyylisidosten lisäämisen. Siinä tapauksessa nämä kaksi isomeeriä ovat yleensä riittävän stabiileja eristettäväksi ja käsiteltäväksi erillisinä aineina. Näiden isomeerien sanotaan sitten olevan molekyylin eri konfiguraatioisomeerejä tai "kokoonpanoja", ei vain kahta eri konformaatiota. (On kuitenkin pidettävä mielessä, että termit "konformaatio" ja "kokoonpano" ovat suurelta osin synonyymejä kemian ulkopuolella, ja niiden erottelu voi olla kiistanalainen jopa kemistien keskuudessa.)
Vuorovaikutukset muiden saman tai eri yhdisteiden molekyylien kanssa (esimerkiksi vetysidosten kautta ) voivat merkittävästi muuttaa molekyylin konformaatioiden energiaa. Siksi yhdisteen mahdolliset isomeerit liuoksessa tai sen nestemäisessä ja kiinteässä faasissa voivat olla hyvin erilaisia kuin tyhjiössä eristetyn molekyylin isomeerit. Jopa kaasufaasissa jotkut yhdisteet, kuten etikkahappo, esiintyvät enimmäkseen dimeerien tai suurempien molekyyliryhmien muodossa, joiden kokoonpanot voivat olla erilaisia kuin eristetyn molekyylin.
Enantiomeerit
Kahden yhdisteen sanotaan olevan enantiomeerejä, jos niiden molekyylit ovat toistensa peilikuvia, joita ei voida saada samaan aikaan vain kiertämällä tai kääntämällä - kuten vasen käsi ja oikea käsi. Näiden kahden muodon sanotaan olevan kiraalinen .
Klassinen esimerkki on bromikloorifluorimetaani ( ). Nämä kaksi enantiomeeriä voidaan erottaa esimerkiksi sen mukaan, kääntyykö polku myötäpäivään vai vastapäivään vetyatomista katsottuna. Jotta yksi konformaatio muuttuisi toiseksi, näiden neljän atomin olisi jossakin vaiheessa oltava samassa tasossa - mikä edellyttäisi voimakasta rasitusta tai katkaisua sidoksensa hiiliatomiin. Vastaava energiaeste kahden konformaation välillä on niin korkea, että niiden välillä ei käytännössä tapahdu muutosta huoneenlämpötilassa, ja niitä voidaan pitää erilaisina kokoonpanoina.
Yhdiste kloorifluorimetaani sitä vastoin ei ole kiraalinen: sen molekyylin peilikuva saadaan myös puolikierroksella sopivan akselin ympäri.
Toinen esimerkki kiraalisesta yhdisteestä on 2,3-pentadieeni , hiilivety, joka sisältää kaksi päällekkäistä kaksoissidosta. Kaksoissidokset ovat sellaisia, että kolme keskimmäistä hiiltä ovat suorassa linjassa, kun taas kolme ensimmäistä ja kolme viimeistä ovat kohtisuorassa tasossa. Molekyyli ja sen peilikuva eivät ole päällekkäin, vaikka molekyylillä on symmetria -akseli. Nämä kaksi enantiomeeriä voidaan erottaa esimerkiksi oikean käden säännön perusteella . Tämän tyyppistä isomeriaa kutsutaan aksiaaliseksi isomerismiksi .
Enantiomeerit käyttäytyvät identtisesti kemiallisissa reaktioissa paitsi silloin, kun ne saatetaan reagoimaan kiraalisten yhdisteiden kanssa tai kiraalisten katalyyttien , kuten useimpien entsyymien , läsnä ollessa . Tästä jälkimmäisestä syystä useimpien kiraalisten yhdisteiden kahdella enantiomeerillä on yleensä selvästi erilaiset vaikutukset ja roolit elävissä organismeissa. In biokemian ja Food Science , kahden enantiomeerin kiraalisen molekyylin - kuten glukoosi - tunnistetaan yleensä, ja käsitellään hyvin erilaisia aineita.
Jokainen kiraalisen yhdisteen enantiomeeri pyörii tyypillisesti sen läpi kulkevan polarisoidun valon tasoa . Pyörimisellä on sama suuruus, mutta vastakkaiset aistit molemmille isomeereille, ja se voi olla hyödyllinen tapa erottaa ja mitata niiden pitoisuus liuoksessa. Tästä syystä enantiomeerejä kutsuttiin aiemmin "optisiksi isomeereiksi". Tämä termi on kuitenkin epäselvä ja IUPAC ei suostu siihen .
Stereoisomeerejä, jotka eivät ole enantiomeerejä, kutsutaan diastereomeereiksi . Jotkut diastereomeerit voivat sisältää kiraalisen keskuksen , jotkut eivät.
Jotkut enantiomeeriparit (kuten trans -syklo -okteenin parit ) voidaan muuttaa keskenään sisäisillä liikkeillä, jotka muuttavat sidoksen pituutta ja kulmaa vain vähän. Muita pareja (kuten CHFClBr) ei voida muuntaa keskenään rikkomatta sidoksia, ja siksi ne ovat erilaisia kokoonpanoja.
Cis-trans-isomerismi
Kahden hiiliatomin välinen kaksoisside pakottaa loput neljä sidosta (jos ne ovat yksittäisiä) olemaan samalla tasolla kohtisuorassa sidoksen tasoon, joka määritetään sen π -kiertoradalla . Jos kummankin hiilen kaksi sidosta yhdistyvät eri atomeihin, ovat mahdollisia kaksi erillistä konformaatiota, jotka eroavat toisistaan yhden hiilen 180 asteen kierrosta kaksoissidoksen ympärillä.
Klassinen esimerkki on dikloorieteeni , erityisesti rakenteellinen isomeeri, jossa on yksi kloori sitoutunut kuhunkin hiileen. Siinä on kaksi konformaatioisomeeriä, joissa kaksi klooria on kaksoissidoksen tason samalla puolella tai vastakkaisilla puolilla. Niitä kutsutaan perinteisesti cisiksi (latinaksi tarkoittaa "tällä puolella") ja transiksi ("toisella puolella"); tai Z ja E on IUPAC suositellaan nimikkeistön. Näiden kahden muodon muuntaminen vaatii yleensä tilapäisen sidosten katkaisemisen (tai kaksoissidoksen muuttamisen yksinkertaiseksi sidokseksi), joten näitä kahta pidetään molekyylin eri kokoonpanona.
Yleisemmin, cis - trans- isomerian (aiemmin nimeltään "geometrinen isomeria") tapahtuu molekyylien, joissa suhteellinen orientaatio kaksi erotettavissa funktionaalisia ryhmiä on rajoitettu jonkin verran jäykkä kehys muiden atomien.
Esimerkiksi syklisessä alkoholin inositolissa (kuusinkertainen sykloheksaanialkoholi) kuuden hiilen syklinen runko estää suurelta osin kunkin hiilen hydroksyylin ja vedyn vaihtamisen paikasta. Siksi yhdellä on erilaiset konfiguraatioisomeerit sen mukaan, onko kukin hydroksyyli renkaan keskitason "tällä puolella" tai "toisella puolella". Jos dispergoidaan isomeerit, jotka ovat ekvivalentteja kiertoissa, on yhdeksän isomeeriä, jotka eroavat toisistaan tällä kriteerillä ja toimivat erilaisina stabiileina aineina (kaksi niistä on toistensa enantiomeerejä). Luonnossa yleisimmässä ( myo -inositolissa) on hydroksyylejä hiileissä 1, 2, 3 ja 5 samassa tasossa, ja siksi sitä voidaan kutsua cis -1,2,3,5 -trans -4, 6-sykloheksaaniheksoli. Ja jokainen näistä cis - trans -isomeerien voi mahdollisesti olla vakaa "tuoli" tai "veneessä" konformaatiot (vaikka esteet näiden ovat huomattavasti alhaisemmat kuin eri cis - trans -isomeerit).

Cis- ja trans -isomeerejä esiintyy myös epäorgaanisissa koordinaatioyhdisteissä , kuten neliömäisissä tasomaisissa komplekseissa ja oktaedrisissa komplekseissa.
Monimutkaisemmille orgaanisille molekyyleille cis- ja trans -leimat ovat epäselviä. IUPAC suosittelee tarkempaa merkintäjärjestelmää, joka perustuu CIP -prioriteetteihin kunkin hiiliatomin sidoksille.
Keskukset, joilla ei ole vastaavia joukkovelkakirjalainoja
Yleisemmin atomit tai atomiryhmät, jotka voivat muodostaa kolme tai useampia ei-ekvivalentteja yksittäissidoksia (kuten siirtymämetallit koordinaatioyhdisteissä), voivat synnyttää useita stereoisomeerejä, kun näissä kohdissa on kiinnittynyt erilaisia atomeja tai ryhmiä. Sama pätee, jos keskuksessa, jossa on kuusi tai useampia vastaavia sidoksia, on kaksi tai useampia substituentteja.
Esimerkiksi yhdisteessä fosforiatomin ja viiden halogeenin välisillä sidoksilla on suunnilleen trigonaalinen bipyramidaalinen geometria . Siten kaksi stereoisomeeriä, joilla on tämä kaava, ovat mahdollisia sen mukaan, onko klooriatomilla yksi kahdesta "aksiaalisesta" asemasta vai yksi kolmesta "päiväntasaajan" asemasta.
Yhdisteelle on mahdollista kolme isomeeriä, joissa nolla, yksi tai kaksi klooria aksiaalisissa asennoissa.
Toisena esimerkkinä kompleksilla, jolla on kaava kuten , jossa keskusatomi M muodostaa kuusi sidosta, joilla on oktaedrinen geometria , on vähintään kaksi kasvojen ja meridionalien isomeeriä sen mukaan, onko kolme sidosta (ja siten myös kolme sidosta) suunnattu oktaedrin ( fas -isomeeri) yhden pinnan kolme kulmaa tai sijaitsevat sen samalla päiväntasaajan tai "meridiaanitasolla" ( mer -isomeeri).
Rotameerit ja atropisomeerit
Kaksi molekyylin osaa, jotka on kytketty yhdellä ainoalla sidoksella, voivat pyöriä tämän sidoksen ympärillä. Vaikka sidos itsessään on välinpitämätön kyseiselle pyörimiselle, molempien osien atomien väliset vetovoimat ja hylkyt aiheuttavat normaalisti koko molekyylin energian vaihtelun (ja mahdollisesti myös kahden osan muodonmuutoksen) riippuen suhteellisesta kiertokulmasta φ kaksi osaa. Sitten on yksi tai useampi erikoisarvo φ, jolle energia on paikallisessa minimissä. Molekyylin vastaavia konformaatioita kutsutaan rotaatioisomeereiksi tai rotameereiksi .
Näin ollen, esimerkiksi, käytettäessä etaani -molekyylin , kaikki sidoskulmien ja pituus ovat tiukasti rajoitettu, paitsi että kaksi metyyli ryhmät voivat toisistaan riippumatta pyöriä akselin ympäri. Siten, vaikka nämä kulmat ja etäisyydet oletetaankin kiinteiksi, etaanimolekyylillä on äärettömän paljon konformaatioita, jotka eroavat kahden ryhmän välisestä suhteellisesta kiertokulmasta φ. Heikko repulsio vetyatomien välillä kahdessa metyyliryhmässä saa energian minimoitumaan kolmella erityisellä arvolla φ, 120 °: n päässä toisistaan. Näissä kokoonpanoissa kuusi tasoa tai ovat 60 °: n päässä toisistaan. Jos koko molekyylin kierrosta ei oteta huomioon, tämä kokoonpano on yksi isomeeri-ns. Porrastettu konformaatio.
Kierto kahden puoliskon väliin molekyylin 1,2-dikloorietaania ( myös on kolme paikallista energia minimit, mutta niillä on erilaisia energioita johtuen eroista , ja vuorovaikutukset. Siksi on olemassa kolme rotameerien a trans- isomeeri, jossa kaksi kloorit samassa tasossa kuin kaksi hiiltä, mutta suunnattuina vastakkain joukkovelkakirjojen ja kaksi kömpelö isomeerit, peilikuvia toisistaan, jossa kaksi ryhmää pyöritetään 109 °, että kanta. laskettu energia ero trans ja kömpelö on ~ 1,5 kcal / mol, este varten ~ 109 ° kierto trans ja kömpelö on ~ 5 kcal / mol, ja että on ~ 142 ° pyörimisen yhdestä kömpelö sen enantiomeeri ~ 8 kcal / mol. osalta tilanne butaani on samanlainen , mutta näennäisesti alhaisemmilla gauche -energioilla ja esteillä.
Jos molekyylin kaksi osaa, jotka on kytketty yhdellä sidoksella, ovat suuria tai varautuneita, energiaesteet voivat olla paljon korkeammat. Esimerkiksi bifenyyliyhdisteessä - kaksi fenyyliryhmää, jotka on kytketty yhdellä sidoksella - hylkiminen vetyatomien välillä, jotka ovat lähimpänä yksittäistä sidosta, antaa täysin tasomaisen konformaation, jossa kaksi rengasta ovat samalla tasolla, korkeampaa energiaa kuin konformaatiot, joissa kaksi rengasta on vinossa. Kaasufaasissa molekyylissä on siten ainakin kaksi rotameeriä, joiden rengastasot on kierretty ± 47 °, jotka ovat toistensa peilikuvia. Niiden välinen este on melko alhainen (~ 8 kJ /mol). Tämä steerinen estovaikutus on voimakkaampi, kun nämä neljä vetyä korvataan suuremmilla atomeilla tai ryhmillä, kuten klooreilla tai karboksyyleillä . Jos este on riittävän korkea, jotta kaksi rotameeriä voidaan erottaa stabiileiksi yhdisteiksi huoneenlämpötilassa, niitä kutsutaan atropisomeereiksi .
Topoisomeerit
Suurilla molekyyleillä voi olla isomeerejä, jotka eroavat toisistaan avaruuden yleisen järjestelyn topologian mukaan, vaikka niitä ei erottaisi erityinen geometrinen rajoitus. Esimerkiksi pitkät ketjut voidaan kiertää muodostaen topologisesti erilliset solmut , joiden keskinäinen muuntaminen estetään suurilla substituenteilla tai syklin sulkemisella (kuten pyöreissä DNA- ja RNA -plasmideissa ). Jotkut solmut voivat tulla peilikuvan enantiomeeripareina. Tällaisia muotoja kutsutaan topologisiksi isomeereiksi tai topoisomeereiksi .
Lisäksi kaksi tai useampia tällaisia molekyylejä voidaan sitoa yhteen katenaanissa tällaisilla topologisilla sidoksilla, vaikka niiden välillä ei olisi kemiallista sidosta. Jos molekyylit ovat riittävän suuria, kytkentä voi tapahtua useilla topologisesti eri tavoilla muodostaen erilaisia isomeerejä. Häkkiyhdisteet , kuten helium, joka on suljettu dodekaedraaniin (He@ C
20H
20) ja hiilen peapodit , ovat samanlainen topologinen isomerismi, johon kuuluu molekyylejä, joilla on suuret sisäiset ontelot, joissa on rajoitettuja aukkoja tai ei ollenkaan.
Isotoopit ja linkous
Isotopomeerit
Saman alkuaineen erilaisia isotooppeja voidaan pitää erilaisina atomeina laskettaessa molekyylin tai ionin isomeerejä. Yhden tai useamman atomin korvaaminen niiden isotoopeilla voi luoda useita rakenteellisia isomeerejä ja/tai stereoisomeerejä yhdestä isomeeristä.
Esimerkiksi, kun kaksi tavallisen vedyn ( ) atomia korvataan deuteriumilla ( , tai ) etaanimolekyylillä , saadaan kaksi erillistä rakenteellista isomeeriä riippuen siitä, ovatko substituutiot samalla hiilellä (1,1-dideuteroetaani ) vai yksi kummassakin hiili (1,2-dideuteroetaani, ); ikään kuin substituentti olisi kloori deuteriumin sijasta. Nämä kaksi yhdistettä eivät muutu helposti toisiinsa ja niillä on erilaisia ominaisuuksia, kuten niiden mikroaaltospektri .
Toinen esimerkki olisi korvata yksi deuteriumiatomi yhdellä kloorifluorimetaanissa olevista vetyistä ( ). Vaikka alkuperäinen yhdiste ei ole kiraalinen ja sillä on yksi isomeeri, substituutio luo parin kiraalisia enantiomeerejä , jotka voitaisiin erottaa (ainakin teoriassa) niiden optisen aktiivisuuden perusteella.
Kun kaksi isomeeriä olisi identtinen, jos kunkin alkuaineen kaikki isotoopit korvattaisiin yhdellä isotoopilla, niitä kuvataan isotopomeereiksi tai isotooppisomeereiksi. Yllä olevissa kahdessa esimerkissä, jos kaikki korvataan , kahdesta dideuteroetaanista tulee molemmat etaania ja kahdesta deuterokloorifluorimetaanista tulee molemmat .
Isotopomeerien käsite on erilainen kuin isotopologit tai isotooppihomologit, jotka eroavat isotooppikoostumuksestaan. Esimerkiksi ja ovat isotopologeja eivätkä isotopomeerejä, eivätkä siksi ole toistensa isomeerejä.
Spin -isomeerit
Toinen isomeerityyppi, joka perustuu ydinominaisuuksiin , on spin -isomerismi , jossa molekyylit eroavat vain ainesosien ainesosien suhteellisista spinneistä . Tämä ilmiö on merkittävä molekyylivedyn osalta, joka voidaan osittain jakaa kahteen spin -isomeeriin: parahydrogeeni, jossa kahden ytimen spinit osoittavat päinvastaisella tavalla, ja ortovety, jossa spinit osoittavat samalla tavalla.
Ionisointi ja elektroninen viritys
Sama isomeeri voi olla myös eri herätetiloissa , jotka eroavat toisistaan elektroniensa kvanttitilan mukaan. Esimerkiksi happimolekyyli voi olla triplettitilassa tai yhdessä kahdesta singlettilasta . Näitä ei pidetä eri isomeereinä, koska tällaiset molekyylit hajoavat yleensä spontaanisti pienimmän energian viritystilaansa suhteellisen lyhyessä ajassa.
Samoin polyatomisia ioneja ja molekyylejä, jotka eroavat toisistaan vain lisäämällä tai poistamalla elektroneja, kuten happea tai peroksidi -ionia, ei pidetä isomeereinä.
Isomerointi
Isomerointi on prosessi, jossa yksi molekyyli muutetaan toiseksi molekyyliksi, jolla on täsmälleen samat atomit, mutta atomit järjestetään uudelleen. Joissakin molekyyleissä ja tietyissä olosuhteissa isomerointi tapahtuu spontaanisti. Monet isomeerit ovat sidosenergiassa yhtä suuret tai suunnilleen yhtä suuret , ja näin ollen niitä on suunnilleen yhtä paljon, jos ne voivat muuttua toisiinsa suhteellisen vapaasti, eli kahden isomeerin välinen energiaeste ei ole liian korkea. Kun isomerointi tapahtuu molekyylisisäisesti , sitä pidetään uudelleenjärjestelyreaktiona .
Esimerkki metalliorgaanisesta isomeroinnista on dekafenyylifferrokseenin, [(η 5 -C 5 Ph 5 ) 2 Fe] tuotanto sen kytkentäisomeerista .
- Fumaarihapon synteesi
Fumaarihapon teollinen synteesi etenee maleiinihapon cis-trans-isomeroinnin kautta :
Topoisomeraasit ovat entsyymejä, jotka voivat leikata ja uudistaa pyöreää DNA: ta ja siten muuttaa sen topologiaa.
Lääketieteellinen kemia
Isomeerit, joilla on selviä biologisia ominaisuuksia, ovat yleisiä; esimerkiksi metyyliryhmien sijoittaminen . Substituoidussa ksantiinit , teobromiinia , löytyy suklaata, on vasodilator joitakin vaikutuksia yhteistä kofeiini ; mutta jos jompikumpi kahdesta metyyliryhmästä siirretään eri asentoon kahden renkaan ytimessä, isomeeri on teofylliini , jolla on erilaisia vaikutuksia, mukaan lukien keuhkoputkia laajentava ja tulehdusta ehkäisevä vaikutus. Toinen esimerkki tästä esiintyy fenetyyliamiinipohjaisissa piristeissä. Fentermiini on ei-kiraalinen yhdiste, jolla on heikompi vaikutus kuin amfetamiinilla . Sitä käytetään ruokahalua vähentävänä lääkkeenä ja sillä on lieviä tai ei lainkaan piristäviä ominaisuuksia. Vaihtoehtoinen atomijärjestely antaa kuitenkin dekstrometamfetamiinia , joka on voimakkaampi piriste kuin amfetamiini.
On lääketieteellisen kemian ja biokemian, enantiomeerit ovat erityisen huolenaihe, koska niillä voi olla eri biologista aktiivisuutta . Monet valmistelumenettelyt tarjoavat seoksen, jossa on yhtä suuret määrät molempia enantiomeerisiä muotoja. Joissakin tapauksissa enantiomeerit erotetaan kromatografialla käyttämällä kiraalisia kiinteitä faaseja. Ne voidaan myös erottaa muodostamalla diastereomeerisuolat . Muissa tapauksissa on kehitetty enantioselektiivinen synteesi .
Epäorgaanisena esimerkkinä sisplatiini (ks. Rakenne edellä) on tärkeä lääke, jota käytetään syövän kemoterapiassa, kun taas trans -isomeerillä (transplatiinilla) ei ole hyödyllistä farmakologista aktiivisuutta.
Historia
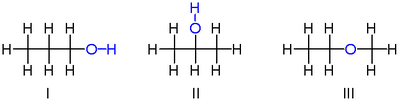
Isomerismi havaittiin ensimmäisen kerran vuonna 1827, kun Friedrich Wöhler valmisti hopeasyanaattia ja havaitsi, että vaikka sen alkuaineiden koostumus oli identtinen hopeatulfaatin kanssa (valmistaja Justus von Liebig edellisenä vuonna), sen ominaisuudet olivat erottuvia. Tämä havainto haastoi aikaan vallitsevan kemiallisen käsityksen, jonka mukaan kemialliset yhdisteet voisivat olla erillisiä vain, kun niiden alkuaineet koostuvat toisistaan. (Tiedämme nyt, että fulminaatin ja syanaatin sidosrakenteet voidaan kuvata suunnilleen ≡ ja vastaavasti.)
Muita esimerkkejä löydettiin seuraavina vuosina, kuten Wöhlerin 1828 havainto, jonka mukaan urealla on sama atomikoostumus ( ) kuin kemiallisesti erilaisella ammoniumsyanaatilla . (Niiden rakenteiden tiedetään nyt olevan ja vastaavasti.) Vuonna 1830 Jöns Jacob Berzelius esitteli ilmiön kuvaamiseksi termin isomerismi .
Vuonna 1848 Louis Pasteur havaitsi, että viinihappokiteistä tuli kahdenlaisia muotoja, jotka olivat toistensa peilikuvia. Erottamalla kiteet käsin, hän sai kaksi versiota viinihaposta, joista kumpikin kiteytyi vain yhdessä kahdesta muodosta, ja pyöritti polarisoidun valon tasoa samassa määrin, mutta vastakkaisiin suuntiin.


























































![{\ displaystyle {\ ce {[NH+4] [O = C = N^{-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6d88ac58af5dbab726d06cd37724e55e9cac30ba)