Munuaissyöpä - Renal cell carcinoma
| Munuaissolukarsinooma | |
|---|---|
 | |
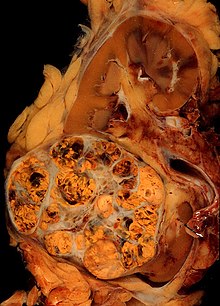
| Mikrokuva yleisimmistä munuaissolukarsinoomatyypeistä (kirkas solu) - kuvan oikealla puolella; ei-kasvain munuainen on kuvan vasemmalla puolella. Nefrectomy -näyte. H&E tahra | |
| Erikoisuus | Onkologia |
Munuaissolukarsinooma ( RCC ) on munuaissyöpä, joka on peräisin proksimaalisen kiertyneen tubuluksen vuorauksesta , joka on osa munuaisten hyvin pieniä putkia, jotka kuljettavat ensisijaista virtsaa. RCC on yleisin munuaissyövän tyyppi aikuisilla, ja se aiheuttaa noin 90–95% tapauksista. RCC -esiintyminen osoittaa miesten hallitsevan naisia suhteessa 1,5: 1. RCC esiintyy yleisimmin 6. ja 7. vuosikymmenen välillä.
Ensimmäinen hoito on useimmiten joko munuaisten tai munuaisten osittainen tai täydellinen poistaminen. Jos syöpä ei ole metastasoitunut (levinnyt muihin elimiin) tai kaivanut syvemmälle munuaiskudoksiin, viiden vuoden eloonjäämisaste on 65–90%, mutta tämä laskee huomattavasti, kun syöpä on levinnyt.
Keho on erittäin hyvä piilottamaan oireet, ja sen seurauksena ihmisillä, joilla on RCC, on usein pitkälle edennyt sairaus siihen mennessä, kun se havaitaan. RCC: n ensimmäiset oireet sisältävät usein verta virtsassa (esiintyy 40%: lla potilaista, kun he hakevat ensin lääkärin apua), kylkikipu (40%), massa vatsassa tai kyljessä (25%), laihtuminen (33%), kuume (20%), korkea verenpaine (20%), yöhikoilu ja yleinen huonovointisuus . Kun RCC metastasoi, se leviää yleisimmin imusolmukkeisiin , keuhkoihin , maksaan , lisämunuaisiin , aivoihin tai luuihin. Immunoterapia ja kohdennettu hoito ovat parantaneet metastaattisen RCC: n näkymiä.
RCC liittyy myös useisiin paraneoplastisiin oireyhtymiin (PNS), jotka ovat joko kasvaimen tuottamien hormonien tai kehon hyökkäyksen kasvaimeen aiheuttamia tiloja ja joita esiintyy noin 20%: lla potilaista, joilla on RCC. Nämä oireyhtymät vaikuttavat yleisimmin kudoksiin, joihin syöpä ei ole hyökännyt. Yleisimmät PNS: t, joita havaitaan ihmisillä, joilla on RCC, ovat: korkea veren kalsiumpitoisuus , korkea punasolumäärä , korkea verihiutaleiden määrä ja sekundaarinen amyloidoosi .
Merkit ja oireet
Historiallisesti lääkärit odottivat henkilön esittävän kolme havaintoa. Tämä klassinen kolmikko on 1: hematuria , jolloin virtsassa on verta, 2: kylkikipu, joka on kipua kehon puolella lonkan ja kylkiluiden välissä, ja 3: vatsan massa, joka on samanlainen kuin turvotus, mutta suurempi. Nyt tiedetään, että tämä klassinen oireiden kolmikko esiintyy vain 10-15% tapauksista, ja se on yleensä merkki siitä, että munuaissolukarsinooma (RCC) on edennyt. Nykyään RCC on usein oireeton (eli oireita on vähän tai ei lainkaan) ja se havaitaan yleensä sattumalta, kun henkilöä tutkitaan muiden sairauksien varalta.
Muita merkkejä ja oireita voivat olla hematuria ; lanne kipu; vatsan massa; huonovointisuus , joka on yleinen huonovointisuus; laihtuminen ja/tai ruokahaluttomuus; anemia, joka johtuu erytropoietiinin masennuksesta ; erytrosytoosi (lisääntynyt tuotanto punasolujen ) lisääntyneiden erytropoietiinin erityksen; kiveskohju , joka nähdään miehillä kimpiksen tyhjennyksen laskimokalvon plexuksen (useammin vasemman kiveksen) kohonnut verenpaine (korkea verenpaine), joka johtuu reniinin erittymisestä kasvaimen kautta; hyperkalsemia , joka on veren kalsiumpitoisuuden nousu; unihäiriöt tai yöhikoilu toistuvat kuumeet ; ja krooninen väsymys.
Riskitekijät
Elämäntapa
Suurimmat riskitekijät RCC: lle ovat elämäntapaan liittyvät; tupakoinnin, liikalihavuuden ja verenpaineen (korkea verenpaine) on arvioitu aiheuttavan jopa 50% tapauksista. Työperäistä altistumista joillekin kemikaaleille, kuten asbestille, kadmiumille, lyijylle, klooratulle liuottimelle, petrokemikaalille ja PAH: lle ( polysyklinen aromaattinen hiilivety ), on tutkittu useissa tutkimuksissa, mutta tulokset ovat epäselviä. Toinen epäilty riskitekijä on ei-steroidisten tulehduskipulääkkeiden (NSAID) pitkäaikainen käyttö .
Lopuksi tutkimukset ovat osoittaneet, että naisilla, joille on tehty kohdunpoisto, on yli kaksinkertainen riski saada RCC kuin niillä, joilla ei ole. Toisaalta kohtuullisella alkoholinkulutuksella on osoitettu olevan suojaava vaikutus.
Genetiikka
Perinnöllisillä tekijöillä on vähäinen vaikutus yksilölliseen herkkyyteen, kun RCC -potilaiden lähisukulaisilla on kaksi tai neljä kertaa suurempi riski sairastua. Muut geneettisesti liittyvät tilat lisäävät myös RCC: n riskiä, mukaan lukien perinnöllinen papillaarinen munuaiskarsinooma , perinnöllinen leiomyomatoosi , Birt-Hogg-Dube -oireyhtymä , hyperparatyreoosi-leukatuumori-oireyhtymä , perinnöllinen papillaarinen kilpirauhaskarsinooma , von Hippel-Lindau -tauti ja sirppisolusairaus .
Merkittävin riskiin vaikuttava sairaus ei kuitenkaan liity geneettisesti toisiinsa - potilaat, joilla on hankittu munuaisten kystinen sairaus ja jotka tarvitsevat dialyysiä, ovat 30 kertaa todennäköisempiä kuin väestö sairastamaan RCC: tä.
Patofysiologia
Kasvain syntyy proksimaalisen munuaistiehyen epiteelin soluista . Sitä pidetään adenokarsinoomana . On olemassa kaksi alatyyppiä: satunnainen (eli ei-perinnöllinen) ja perinnöllinen. Molemmat tällaiset alatyypit liittyvät mutaatioihin kromosomin 3 lyhyessä haarassa , ja niihin liittyvät geenit ovat joko tuumorisuppressorigeenejä ( VHL ja TSC ) tai onkogeenejä (kuten c-Met ).
Diagnoosi
Ensimmäiset vaiheet tämän tilan diagnosoimiseksi ovat merkkien ja oireiden huomioon ottaminen ja sairaushistoria (yksityiskohtainen lääketieteellinen katsaus aiemmasta terveydentilasta) riskitekijöiden arvioimiseksi. Esitettyjen oireiden perusteella erilaisia biokemiallisia testejä (joissa käytetään veri- ja/tai virtsanäytteitä) voidaan myös pitää osana seulontaprosessia, jotta saadaan riittävä määrällinen analyysi kaikista elektrolyyttien , munuaisten ja maksan toiminnan ja veren hyytymisaikojen eroista . Fyysisessä tutkimuksessa vatsan palpointi voi paljastaa massan tai elimen laajentumisen.
Vaikka tämä sairaus ei ole karakterisoitu kasvaimen kehittymisen alkuvaiheessa, erilaisiin kliinisiin ilmenemismuotoihin perustuvat näkökohdat sekä säteily- ja kemoterapiaresistenssi ovat tärkeitä. Tärkeimmät diagnostiset työkalut munuaissolusyövän havaitsemiseksi ovat ultraääni , tietokonetomografia (CT) ja munuaisten magneettikuvaus (MRI).
Luokitus
Munuaissyöpä (RCC) ei ole yksittäinen kokonaisuus, vaan pikemminkin kokoelma erityyppisiä kasvaimia , joista jokainen on peräisin nefronin eri osista ( epiteeli tai munuaistiehyet ) ja joilla on erilliset geneettiset ominaisuudet, histologiset piirteet ja joillekin laajuudessa, kliiniset fenotyypit.
| Munuaissolukarsinooman yleisten histologisten alatyyppien luokittelu | |||
|---|---|---|---|
| Munuaissolusyövän alatyyppi | Taajuus | Geneettiset poikkeavuudet | Ominaisuudet |
|
Tyhjennä munuaissolukarsinooma (CCRCC) 
Yleensä soluilla on kirkas sytoplasma , niitä ympäröi erillinen solukalvo ja ne sisältävät pyöreitä ja yhtenäisiä ytimiä .
|
60–70% |
|
|
Papillaarinen munuaissyöpä (PRCC)
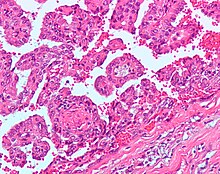
Tyypin 1 PRCC koostuvat pötsinystyt peitetty yhden tai kahden kerroksen pienten kuution solujen kanssa niukka sytoplasmaan ja tyypin 2 PRCC koostuvat pötsinystyt, joita suuri eosinofiilinen solut, jotka on järjestetty epäsäännöllinen tai valekerrostunut tavalla.
|
10–15% |
|
|
Chromophobe munuaissolukarsinooma (ChRCC)

ChRCC koostuu kasvainsoluista, joissa on runsaasti eosinofiilistä sytoplasmaa (vaaleat solut ja eosinofiiliset solut, joissa on perinukleaarinen halo), ja niillä on pääasiassa kiinteä rakenne.
|
3–5% |
|
|
| Melko harvinaisten RCC -alatyyppien kliiniset, patologiset ja geneettiset ominaisuudet, jotka sisältyvät WHO: n RCC -patologialuokitukseen 2004 | ||||
|---|---|---|---|---|
| RCC -alatyyppi | Kliiniset ominaisuudet | Solun/kudoksen ominaisuudet | Genetiikka | Ennuste |
| Monisilmäinen kystinen RCC |
|
Kirkas sytoplasma , pienet tummat ytimet | 3p -deleetio, kuten CCRCC: ssä havaittiin |
|
| Bellinin kanavien karsinooma |
|
Korkealaatuiset kasvainsolut, joissa on eosinofiilinen sytoplasma | Muuttuvat tulokset: LOH kromosomeilla 1q, 6p, 8p, 9p, 13q, 19q32 ja 21q; c-erB2-monistus, joka liittyy epäedulliseen lopputulokseen |
|
| Medullaarinen karsinooma |
|
Verenvuoto ja nekroosi , korkealaatuiset kasvainsolut, joissa on eosinofiilinen sytoplasma | Ei hyvin määritelty |
|
| Xp11.2 Translokaatiokarsinooma |
|
|
Kromosomaalinen translokaatio, johon liittyy TFE3 -geeni Xp11.2: ssa, mikä johtaa TFE3 -proteiinin yliekspressioon |
|
| Mucinous Tubular Spindle Cell Carcinoma |
|
Tubulukset, solunulkoinen musiini ja sukkulasolut | Ei hyvin määritelty; Ilmoitetut menetykset kromosomeista 1, 4, 6, 8, 9, 11, 13, 14, 15, 18, 22; 3p -muutokset ja kromosomin 7 ja 17 vahvistus eivät ole läsnä |
|
| Neuroblastooman jälkeinen munuaissolukarsinooma |
|
Eosinofiiliset solut, joilla on onkolysytoidipiirteitä (sama kuin CCRCC) | Ei hyvin määritelty; Havaittu useiden kromosomaalisten lokusten menetys | Samanlainen kuin muut yleiset RCC -alatyypit |
Matriisipohjaista karyotyyppiä voidaan käyttää tunnistamaan ominaiset kromosomipoikkeavuudet munuaiskasvaimissa, joilla on haastava morfologia. Array-pohjainen karyotyypitys toimii hyvin parafiiniin upotetuissa kasvaimissa ja soveltuu rutiininomaiseen kliiniseen käyttöön. Katso myös Virtual Karyotype CLIA-sertifioiduista laboratorioista, jotka tarjoavat joukkopohjaista kiinteiden kasvainten karyotyyppityyppiä.
Vuoden 2004 Maailman terveysjärjestön (WHO) sukupuolielinten kasvainten luokitus tunnistaa yli 40 munuaisten kasvainten alatyyppiä . WHO: n viimeisimmän iteroinnin julkaisemisen jälkeen vuonna 2004 on kuvattu useita uusia munuaistuumorin alatyyppejä:
- Kirkas solu papillaarinen munuaissolukarsinooma ja selkeä solu munuaissolukarsinooma, jossa on sileän lihaksen strooma
- Limakalvon tubulaarinen ja kara -karsinooma (MTSCC)
- Monisilmäinen kystinen kirkkaan solun munuaissolukarsinooma
- Tubulosystinen munuaissolukarsinooma
- Kilpirauhasen kaltainen follikulaarinen munuaissolukarsinooma
- Hankittu kystiseen munuaissairauteen liittyvä munuaissolukarsinooma
- Munuaissyöpä ja t (6; 11) translokaatio (TFEB)
- Hybridi onkosytooma/kromofobinen munuaissolukarsinooma
- Perinnöllinen leiomyomatoosi ja munuaissolukarsinooma (HLRCC)
Laboratoriokokeet
Laboratoriokokeet suoritetaan yleensä silloin, kun potilaalla on merkkejä ja oireita, jotka voivat olla ominaisia munuaisten vajaatoiminnalle. Niitä ei käytetä ensisijaisesti munuaissyövän diagnosointiin, koska se on oireeton, ja ne löytyvät yleensä sattumalta muiden sairauksien, kuten sappirakon sairauden, testien aikana . Toisin sanoen näitä syöpiä ei havaita yleensä, koska ne eivät aiheuta kipua tai epämukavuutta havaittuaan. Laboratorioanalyysien voi antaa arvion yleisestä potilaan terveydentilasta ja voi antaa tietoa määritettäessä lavastus ja aste etäpesäkkeiden muihin kehon osiin (jos munuaisten vaurio on tunnistettu) ennen hoidon antamista.
Virtsa-analyysi
Veren esiintyminen virtsassa on yleinen oletettu merkki munuaissolukarsinoomasta. Hemoglobiini veren aiheuttaa virtsasta on ruosteessa, ruskea tai punainen. Vaihtoehtoisesti virtsatutkimuksella voidaan testata sokeri , proteiini ja bakteerit, jotka voivat myös toimia syövän indikaattoreina . Täydellinen verisolujen määrä voi myös antaa lisätietoja syövän vakavuudesta ja leviämisestä .
Täydellinen verisolujen määrä
CBC tarjoaa kvantifioidun mitan potilaan kokoverinäytteen eri soluista. Tällaisia tässä testissä tutkittuja soluja ovat punasolut ( punasolut ), valkosolut ( leukosyytit ) ja verihiutaleet ( trombosyytit ). Yleinen merkki munuaissolukarsinoomasta on anemia, jossa potilaalla on puutos punasoluissa. CBC -testit ovat elintärkeitä seulontatyökaluna potilaan terveyden tutkimiseen ennen leikkausta. Verihiutaleiden määrän epäjohdonmukaisuudet ovat myös yleisiä näillä syöpäpotilailla, ja muita hyytymistestejä, kuten punasolujen sedimentaatiota (ESR), protrombiiniaikaa (PT), aktivoitua osittaista tromboplastiiniaikaa (APTT), on harkittava.
Veren kemia
Verikemiatestit suoritetaan, jos epäillään munuaissyöpää, koska syöpä voi nostaa tiettyjen kemikaalien määrää veressä. Esimerkiksi maksan entsyymejä, kuten aspartaattiaminotransferaasin (ASAT) ja alaniiniaminotransferaasin (ALT) on todettu olevan poikkeuksellisen korkea. Syövän vaiheet voidaan määrittää myös epänormaaleilla kohonneilla kalsiumpitoisuuksilla, mikä viittaa siihen, että syöpä voi olla metastasoitunut luuhun. Tässä tapauksessa lääkäriä tulee pyytää CT -skannaukseen. Verikemiatestit arvioivat myös munuaisten kokonaistoimintaa ja voivat antaa lääkärin päättää uusista radiologisista testeistä.
Radiologia
Munuaissolukarsinooman (RCC) tyypillinen ulkonäkö on kiinteä munuaisvaurio, joka häiritsee munuaisten muotoa. Sillä on usein epäsäännöllinen tai lobular marginaali, ja sitä voidaan pitää paakuna alemman lantion tai vatsan alueella. Perinteisesti 85–90% kiinteistä munuaismassoista osoittautuu RCC: ksi, mutta kystiset munuaismassat voivat johtua myös RCC: stä. Diagnostisten menetelmien edistyminen pystyy kuitenkin satunnaisesti diagnosoimaan suuren osan potilaista, joilla on munuaisvaurioita, jotka voivat näyttää pieniltä ja hyvänlaatuisilta. Kymmenen prosenttia RCC: stä sisältää kalkkeutumia ja jotkut makroskooppista rasvaa (todennäköisesti johtuen perirenaalisen rasvan hyökkäyksestä ja koteloitumisesta). Munuaismassan hyvän- tai pahanlaatuisesta luonteesta päättäminen sen paikallisen koon perusteella on ongelma, koska munuaissolukarsinooma voi olla myös kystinen. Koska on olemassa useita hyvänlaatuisia kystisiä munuaisvaurioita (yksinkertainen munuaiskysta, verenvuotoinen munuaiskysta, monisilmäinen kystinen munuaissairaus , monirakkulainen munuaissairaus ), radiologin voi joskus olla vaikea erottaa hyvänlaatuinen kystinen vaurio pahanlaatuisesta. Bosniak luokitusjärjestelmä kystinen munuaisten vaurioita luokittelee ne ryhmät, jotka ovat hyvänlaatuisia ja ne, jotka tarvitsevat poistoleikkaus , joka perustuu erityisiin kuvantamisen toimintoja.
Tärkeimmät kuvantamistestit, joita suoritetaan munuaissolukarsinooman tunnistamiseksi, ovat lantion ja vatsan CT -tutkimukset, munuaisten ultraäänitutkimukset (ultraääni), MRI -skannaukset, laskimonsisäinen pyelogrammi (IVP) tai munuaisten angiografia. Näistä tärkeimmistä diagnostisista testeistä voidaan käyttää myös muita radiologisia testejä, kuten erittyvä urografia , positroniemissiotomografia (PET) -skannaus, ultraääni- , arteriografia- , venografia- ja luuskannaus . pahanlaatuiset kasvaimet pahanlaatuisista kasvaimista.
Tietokonetomografia
Kontrastivahvistettua tietokonetomografiaa (CT) käytetään rutiininomaisesti munuaissolusyövän vaiheen määrittämiseen vatsan ja lantion alueilla. CT -skannaus voi erottaa kiinteät massat kystisistä massoista, ja ne voivat antaa tietoa syövän lokalisoinnista, vaiheesta tai leviämisestä potilaan muihin elimiin. Ihmiskehon keskeisiä osia, joita tutkitaan munuaissolusyövän metastaattisen osallisuuden varalta, voivat olla munuaislaskimo , imusolmuke ja alemman vena cavan osallistuminen . Saukin ym. Tekemän tutkimuksen mukaan multidetector CT -kuvantamisominaisuuksilla on sovelluksia diagnosoida potilaita, joilla on selkeä munuaissyöpä kuvaamalla näiden solujen erot sytogeenisellä tasolla.
Ultraääni
Ultraäänitutkimuksessa tutkimus voi olla hyödyllistä arvioitaessa kyseenalainen oireeton munuaisten kasvaimia ja kystinen munuaisten leesiot , jos tietokonetomografia kuvantaminen on epäselvä. Tämä turvallinen ja ei-invasiivinen radiologinen toimenpide käyttää korkeataajuisia ääniaaltoja luodakseen kehon sisäisen kuvan tietokoneen näytöllä. Ultraäänen tuottama kuva voi auttaa diagnosoimaan munuaissolukarsinooman elinten pinnalla olevien ääniheijastuksien ja epänormaalien kudosmassojen perusteella. Pohjimmiltaan ultraäänitestit voivat määrittää, onko munuaismassan koostumus pääasiassa kiinteä vai täynnä nestettä.
Perkutaaninen biopsia voidaan suorittaa radiologi ultraäänellä tai tietokonetomografiaa ohjata näytteenotto kasvaimen varten diagnoosi patologian . Tätä ei kuitenkaan suoriteta rutiininomaisesti, koska kun munuaissolukarsinooman tyypilliset kuvantamisominaisuudet ovat läsnä, väärin negatiivisen tuloksen mahdollisuus ja potilaan lääketieteellisten komplikaatioiden riski voivat tehdä siitä epäedullisen riskin ja hyödyn kannalta. Kuitenkin biopsiatestit molekyylianalyysiä varten hyvänlaatuisten ja pahanlaatuisten munuaiskasvainten erottamiseksi ovat tutkimuksellisia.
Magneettikuvaus
Magneettikuvaus (MRI) antaa kuvan kehon pehmytkudoksista käyttämällä radioaaltoja ja voimakkaita magneetteja. MRI: tä voidaan käyttää CT: n sijasta, jos potilas on allerginen testille annetulle varjoaineelle. Joskus ennen magneettikuvausta annetaan gadolinium -nimisen kontrastimateriaalin laskimonsisäinen injektio, jotta saadaan yksityiskohtaisempi kuva. Dialyysihoitoa saavien potilaiden tai munuaisten vajaatoimintaa sairastavien tulee välttää tätä kontrastimateriaalia, koska se voi aiheuttaa harvinaisen, mutta vakavan sivuvaikutuksen, joka tunnetaan nimellä nefrogeeninen systeeminen fibroosi. Luun skannausta tai aivojen kuvantamista ei suoriteta rutiininomaisesti, elleivät merkit tai oireet viittaa mahdolliseen metastaattiseen osallisuuteen näillä alueilla. MRI -skannauksia on myös harkittava, jotta voidaan arvioida kasvaimen laajentumista, joka on kasvanut suurissa verisuonissa, mukaan lukien vena cava , vatsassa. Magneettikuvauksella voidaan tarkkailla syövän mahdollista leviämistä aivoihin tai selkäytimeen, jos potilaalla ilmenee oireita, jotka viittaavat siihen, että näin voi olla.
Laskimonsisäinen pyelogrammi
Laskimonsisäinen pyelogrammi (IVP) on hyödyllinen menetelmä epänormaalin munuaismassan havaitsemiseksi virtsateissä . Tämä toimenpide sisältää kontrastiväriaineen ruiskutuksen potilaan käsivarteen. Väriaine kulkee verenkierrosta munuaisiin, jotka ajan myötä kulkeutuvat munuaisiin ja virtsarakkoon. Tämä testi ei ole tarpeen, jos CT- tai MRI -skannaus on suoritettu.
Munuaisten angiografia
Munuaisten angiografia käyttää samaa periaatetta kuin IVP, koska tämäntyyppinen röntgenkuva käyttää myös kontrastiväriainetta. Tämä radiologinen testi on tärkeä diagnosoitaessa munuaissolukarsinoomaa apuna munuaisten verisuonten tutkimiseen . Tämä diagnostinen testi perustuu varjoaineeseen, joka ruiskutetaan munuaisvaltimoon imeytymään syöpäsoluihin. Kontrastiväriaine antaa selkeämmän linjan epänormaalisti suuntautuneista verisuonista, joiden uskotaan liittyvän kasvaimeen. Tämä on välttämätöntä kirurgeille, koska sen avulla potilaan verisuonet voidaan kartoittaa ennen leikkausta.
Lavastus
Pysähdyspaikan munuaissyövän on tärkein tekijä ennustettaessa sen ennustetta. Vaihe voi seurata TNM -lavastusjärjestelmää , jossa kasvaimen koko ja laajuus (T), imusolmukkeiden osallistuminen (N) ja etäpesäkkeet (M) luokitellaan erikseen. Se voi myös käyttää vaiheiden yleistä ryhmittelyä vaiheisiin I – IV, ja alla kuvattu vuoden 1997 AJCC -versio:
| Vaihe I | Kasvain, jonka halkaisija on 7 cm (noin 2 3⁄4 tuumaa) tai pienempi ja rajoittuu munuaisiin. Ei imusolmukkeiden osallistumista tai etäpesäkkeitä etäisiin elimiin. |
| Vaihe II | Kasvain on suurempi kuin 7,0 cm, mutta rajoittuu edelleen munuaisiin. Ei imusolmukkeiden osallistumista tai etäpesäkkeitä etäisiin elimiin. |
|
Vaihe III jokin seuraavista |
Kaiken kokoinen kasvain, johon liittyy läheinen imusolmuke, mutta ei etäpesäkkeitä kaukaisiin elimiin. Tämän vaiheen kasvain voi levitä munuaisten ympärillä olevaan rasvakudokseen tai ilman sitä, levitettynä tai levittämättä munuaisesta sydämeen johtaviin suuriin laskimoihin. |
| Kasvain, joka on levinnyt munuaisen ympärillä olevaan rasvakudokseen ja/tai levinnyt munuaisesta sydämeen johtaviin suuriin laskimoihin, mutta leviämättä mihinkään imusolmukkeisiin tai muihin elimiin. | |
|
Vaihe IV jokin seuraavista |
Kasvain, joka on levinnyt suoraan rasvakudoksen ja munuaista ympäröivän sidekudoksen kaltaisen kudoksen läpi. |
| Useamman kuin yhden imusolmukkeen osallistuminen munuaisen lähelle | |
| Minkä tahansa imusolmukkeen osallistuminen, joka ei ole lähellä munuaista | |
| Kaukaiset etäpesäkkeet, kuten keuhkoissa, luussa tai aivoissa. |
Diagnoosin yhteydessä 30% munuaissolukarsinoomista on levinnyt ipsilateraaliseen munuaislaskimoon ja 5–10% on jatkanut huonompaan vena cavaan.
Histopatologia
Munuaissolukarsinoomien karkea ja mikroskooppinen ulkonäkö on hyvin vaihteleva. Munuaissyövässä voi esiintyä punoittavia alueita, joissa verisuonet ovat vuotaneet, ja kystat, jotka sisältävät vetistä nestettä. Kasvaimen kehossa on suuria verisuonia, joiden seinät koostuvat syöpäsoluista. Kokonaistutkimus osoittaa usein kellertävän, monisoluisen kasvaimen munuaiskuoressa , joka sisältää usein nekroosin , verenvuodon ja arpia . Mikroskooppisessa yhteydessä on neljä suurta histologista alatyyppiä munuaissolusyövässä: kirkas solu (tavanomainen RCC, 75%), papillaarinen (15%), kromofobinen (5%) ja keräyskanava (2%). Sarcomatoidimuutoksia (sarkoomaa, karan soluja jäljittelevät IHC: n morfologia ja mallit) voidaan havaita missä tahansa RCC -alatyypissä, ja niihin liittyy aggressiivisempi kliininen kulku ja huonompi ennuste. Valomikroskoopilla näillä kasvainsoluilla voi olla papilloja , tubuluksia tai pesiä, ja ne ovat melko suuria, epätyypillisiä ja monikulmaisia.
Viimeaikaiset tutkimukset ovat kiinnittäneet huomiota syöpäsolutyypin läheiseen yhteyteen sairauden aggressiivisuuteen. Jotkut tutkimukset viittaavat siihen, että nämä syöpäsolut keräävät glykogeenia ja lipidejä, niiden sytoplasma näyttää "kirkkaalta", ytimet jäävät solujen keskelle ja solukalvo on ilmeinen. Jotkut solut voivat olla pienempiä, eosinofiilinen sytoplasma, joka muistuttaa normaaleja putkimaisia soluja. Strooma on pienentynyt, mutta hyvin verisuonittunut. Kasvain puristaa ympäröivän parenkyymin muodostaen pseudokapselin.
Yleisin munuaissolukarsinooman esiintyvä solutyyppi on kirkas solu , joka on nimetty solujen korkean lipidipitoisuuden liukenemisena sytoplasmassa. Kirkkaiden solujen uskotaan leviävän vähiten ja ne reagoivat yleensä edullisemmin hoitoon. Suurin osa kasvaimista sisältää kuitenkin soluseoksen. Munuaissyövän aggressiivisimman vaiheen uskotaan olevan se, jossa kasvain on sekoitettu ja sisältää sekä kirkkaita että rakeisia soluja.
Suositeltuja histologista skeema RCC on Fuhrman järjestelmä (1982), joka on arvio perustuu mikroskooppisen morfologiaa kasvain kanssa hematoksyliinillä ja eosiinilla (H & E-värjäys). Tämä järjestelmä luokittelee munuaissolukarsinooman luokkiin 1, 2, 3, 4 ydinominaisuuksien perusteella. Tiedot Fuhrman -luokitusjärjestelmästä RCC: lle on esitetty alla:
| Arvosana | Ydinominaisuudet |
|---|---|
| Luokka I | Ytimet näyttävät pyöreiltä ja yhtenäisiltä, 10 μm; nucleoli ovat huomaamattomia tai puuttuvat. |
| Luokka II | Ytimillä on epäsäännöllinen ulkonäkö ja merkkejä lohkon muodostumisesta, 15 μm; nukleolit ovat ilmeisiä. |
| Luokka III | Ytimet näyttävät hyvin epäsäännöllisiltä, 20 μm; nukleolit ovat suuria ja näkyvät. |
| Luokka IV | Ytimet näyttävät oudolta ja monilohkoiselta, 20 μm tai enemmän; nukleolit ovat näkyvissä. |
Ydinasteen uskotaan olevan yksi välttämättömistä ennustetekijöistä munuaissolukarsinoomaa sairastavilla potilailla. Kuitenkin Delahunt et ai. (2007) on osoittanut, että Fuhrman -luokitus on ihanteellinen selkeälle solusyövälle, mutta ei välttämättä sovi kromofobisille munuaissolukarsinoomille ja että syövän lavastus (suoritettu CT -skannauksella) on edullisempi ennuste tämän taudin ennusteelle. Mitä tulee munuaissyövän vaiheisiin, Heidelbergin munuaiskasvainten luokitusjärjestelmä otettiin käyttöön vuonna 1976 keinona korreloida täydellisemmin histopatologiset piirteet tunnistettujen geneettisten vikojen kanssa.
Ehkäisy
Munuaissyövän riskiä voidaan pienentää ylläpitämällä normaali paino.
Hallinto

Hoidon tyyppi riippuu useista tekijöistä ja yksilöstä, joista osa sisältää munuaissolusyövän vaiheen (elimet ja kehon osat, joihin vaikuttaa/ei vaikuta), munuaissolusyövän tyypin, olemassa olevat tai samanaikaiset sairaudet ja yleinen terveys ja henkilön ikä. Kaikilla hoitomuodoilla on sekä riskejä että hyötyjä; terveydenhuollon ammattilainen tarjoaa parhaat vaihtoehdot, jotka sopivat yksilöllisiin olosuhteisiin.
Jos se on levinnyt munuaisten ulkopuolelle, usein imusolmukkeisiin , keuhkoihin tai munuaisten päälaskimoon, käytetään useita hoitoja, mukaan lukien leikkaus ja lääkkeet. RCC on useimmissa tapauksissa vastustuskykyinen kemoterapialle ja sädehoidolle, mutta se reagoi hyvin immunoterapiaan interleukiini-2: lla tai alfa-interferonilla, biologisella tai kohdennetulla hoidolla. Varhaisessa vaiheessa krioterapia ja leikkaus ovat edullisia vaihtoehtoja.
Aktiivinen valvonta
Aktiivinen valvonta tai "valppaana odottaminen" on yleistymässä pieniä munuaismassoja tai kasvaimia havaittaessa ja myös vanhemman sukupolven sisällä, kun leikkaus ei aina ole sopiva. Aktiiviseen seurantaan kuuluu erilaisten diagnostisten toimenpiteiden, testien ja kuvantamisen suorittaminen RCC: n etenemisen seuraamiseksi ennen kuin ryhdytään riskialttiimpaan hoitovaihtoehtoon, kuten leikkaukseen. Tämä on erityisen hyödyllistä vanhuksilla, potilailla, joilla on samanaikaisia sairauksia, ja huonoilla kirurgisilla ehdokkailla.
Leikkaus
Eri menettelyt voivat olla sopivimpia olosuhteista riippuen.
Suositeltava hoito munuaissolusyövälle voi olla munuaisten poisto tai osittainen munuaispoisto, munuaisten kokonaan tai osittain poistaminen. Tämä voi sisältää joitain ympäröivistä elimistä tai kudoksista tai imusolmukkeista. Jos syöpä on vain munuaisissa, mikä on noin 60% tapauksista, se voidaan parantaa noin 90% ajasta leikkauksella .
Pieniä munuaiskasvaimia (<4 cm) hoidetaan yhä useammin osittaisella nefrektomialla mahdollisuuksien mukaan. Suurin osa näistä pienistä munuaismassoista ilmentää epätoivoista biologista käyttäytymistä erinomaisella ennusteella. Nefronia säästävää osittaista nefrektomiaa käytetään, kun kasvain on pieni (halkaisijaltaan alle 4 cm) tai kun potilaalla on muita lääketieteellisiä huolenaiheita, kuten diabetes tai hypertensio . Osittainen nefrektomia sisältää vain vaurioituneen kudoksen poistamisen, säästää muuta munuaista, Gerotan faskiaa ja alueellisia imusolmukkeita. Tämä mahdollistaa enemmän munuaisten säilyttämisen verrattuna radikaaliin munuaisten poistoon, ja tällä voi olla positiivisia pitkäaikaisia terveyshyötyjä. Suurempia ja monimutkaisempia kasvaimia voivat myös hoitaa osittainen nefrektomia kirurgit, joilla on paljon kokemusta munuaisleikkauksista.
Kirurginen nefrectomia voi olla "radikaali", jos toimenpide poistaa koko sairastuneen munuaisen, mukaan lukien Gerotan faskian , lisämunuaisen, joka on samalla puolella kuin munuainen, ja alueelliset retroperitoneaaliset imusolmukkeet, kaikki samanaikaisesti. Vaikka tämä menetelmä on vakava, se on tehokas. Mutta se ei ole aina tarkoituksenmukaista, koska se on suuri leikkaus, joka sisältää komplikaatioiden riskin sekä leikkauksen aikana että sen jälkeen ja jonka toipumisaika voi olla pidempi. On tärkeää huomata, että toisen munuaisen on oltava täysin toimiva, ja tätä tekniikkaa käytetään useimmiten silloin, kun vain yhdessä munuaisessa on suuri kasvain.
Tapauksissa, joissa kasvain on levinnyt munuaislaskimoon, huonompaan vena cavaan ja mahdollisesti oikeaan eteiseen, tämäkin osa kasvaimesta voidaan poistaa kirurgisesti. Kun kasvain käsittää alemman laskimolaskimon, on tärkeää luokitella, mitkä suonenlaskun osat ovat osallisina, ja suunnitella sen mukaan, koska joskus täydellinen resektio sisältää viillon rintakehään ja lisää sairastuvuutta. Tästä syystä, tohtori Gaetano Ciancio , joka on sovitettu maksan mobilisointi tekniikoita maksasiirteen ja osoite retrohepatic tai jopa suprahepatic alaonttolaskimo trombin liittyy munuaisten kasvaimia. Tällä tekniikalla koko vatsan huonompi vena cava voidaan mobilisoida. Tämä helpottaa kasvaimen lypsämistä alaspäin suurimpien maksan laskimoiden alapuolella kirurgin sormilla, ohittaen rintakehän ja viillon leikkauksen tai sydän- ja keuhko -ohituksen tarpeen . Tunnetuissa etäpesäkkeissä munuaisen kirurginen resektio ("sytoreduktiivinen nefrektomia") voi parantaa eloonjäämistä sekä yksinäisen etäpesäkeleesion resektio. Munuaiset embolisoidaan joskus ennen leikkausta veren menetyksen minimoimiseksi.
Leikkaus suoritetaan yhä enemmän laparoskooppisilla tekniikoilla. Tätä leikkausta kutsutaan yleisesti avainreiän leikkaukseksi, mutta siinä ei ole suuria viiltoja, joita on havaittu klassisesti suoritetussa radikaalissa tai osittaisessa munuaisten poistossa, mutta se poistaa silti onnistuneesti joko koko munuaisen tai sen osan. Laparoskooppiseen leikkaukseen liittyy lyhyempi sairaalassaolo ja nopeampi toipumisaika, mutta kirurgiseen toimenpiteeseen liittyy edelleen riskejä. Niiden etuna on se, että ne ovat vähemmän taakkaa potilaalle ja tauditon eloonjääminen on verrattavissa avoimen leikkauksen omaan. Pienille eksofyyttisille leesioille, jotka eivät laajasti sisällä suuria verisuonia tai virtsankeräysjärjestelmää, voidaan suorittaa osittainen nefrektomia (kutsutaan myös "nefronien säästäväksi leikkaukseksi"). Tähän voi kuulua verenkierron väliaikainen pysäyttäminen munuaisiin, kun massa poistetaan, sekä munuaisten jäähdytys jäähiekalla. Mannitolia voidaan myös antaa munuaisvaurioiden rajoittamiseksi. Tämä tehdään yleensä avoimen viillon kautta, vaikka pienemmät vauriot voidaan tehdä laparoskooppisesti robotti -avun kanssa tai ilman.
Laparoskooppinen kryoterapia voidaan tehdä myös pienemmille leesioille. Tyypillisesti biopsia otetaan hoidon aikana. Intraoperatiivista ultraääntä voidaan käyttää ohjaamaan jäädytyskoettimien sijoittamista. Sitten suoritetaan kaksi jäädytys-/sulatussykliä tappaakseen kasvainsolut. Koska kasvainta ei poisteta, seuranta on monimutkaisempaa (katso alla) ja yleinen taudista vapaa määrä ei ole yhtä hyvä kuin kirurgisella poistolla saatu.
Leikkaus metastaattiseen sairauteen: Jos metastaattinen sairaus on läsnä, kirurginen hoito voi silti olla toteuttamiskelpoinen vaihtoehto. Radikaali ja osittainen munuaisreikkaus voi silti tapahtua, ja joissakin tapauksissa, jos etäpesäke on pieni, se voidaan myös poistaa kirurgisesti. Tämä riippuu siitä, missä kasvuvaiheessa ja kuinka pitkälle tauti on levinnyt.
Perkutaaniset ablatiiviset hoidot
Perkutaaniset ablaatiohoidot käyttävät radiologien kuvaohjausta paikallisten kasvainten hoitoon, jos kirurginen toimenpide ei ole hyvä vaihtoehto. Vaikka laparoskooppisten kirurgisten tekniikoiden käyttö täydellisiin nefrektomioihin on vähentänyt joitakin leikkaukseen liittyviä riskejä, kaikenlainen leikkaus ei vieläkään ole mahdollista. Esimerkiksi vanhukset, ihmiset, joilla on jo vaikea munuaisten vajaatoiminta, tai ihmiset, joilla on useita muita sairauksia , minkäänlaista leikkausta eivät ole perusteltuja.
Koetin asetetaan ihon läpi kasvaimeen käyttämällä sekä anturin kärjen että kasvaimen reaaliaikaista kuvantamista tietokonetomografialla , ultraäänellä tai jopa magneettikuvauksella ja tuhoamalla sitten kasvain lämmöllä ( radiotaajuuden ablaatio ) tai kylmällä ( kryoterapia ). Nämä menetelmät ovat epäedullisessa asemassa perinteiseen leikkaukseen verrattuna, koska patologinen vahvistus tuumorin täydellisestä tuhoutumisesta ei ole mahdollista. Siksi pitkäaikainen seuranta on ratkaisevan tärkeää kasvaimen ablaation täydellisyyden arvioimiseksi. Ihannetapauksessa perkutaaninen ablaatio rajoittuu alle 3,5 cm: n kasvaimiin ja ohjaa hoitoa. On kuitenkin joitain tapauksia, joissa ablaatiota voidaan käyttää kasvaimiin, jotka ovat suurempia.
Kaksi päätyyppiä ablaatiotekniikoita, joita käytetään munuaissolukarsinoomaan, ovat radiotaajuuden ablaatio ja kryoablaatio .
Rf-ablaatio käyttää elektrodi koetin , joka työnnetään vaurioituneeseen kudokseen, lähettää radiotaajuuksien kudokseen tuottaa lämpöä kitkan vesimolekyylien. Lämpö tuhoaa kasvainkudoksen. Solukuolema tapahtuu yleensä muutamassa minuutissa sen jälkeen, kun se on altistunut yli 50 ° C: n lämpötiloille.
Kryoablaatio sisältää myös koettimen asettamisen vaurioituneelle alueelle, mutta kylmää käytetään tappaa kasvain lämmön sijaan. Anturi jäähdytetään kemiallisilla nesteillä, jotka ovat hyvin kylmiä. Pakkaslämpötilat aiheuttavat kasvainsolujen kuoleman aiheuttaen osmoottista dehydraatiota , joka vetää veden ulos solusta tuhoamalla entsyymin , organellit , solukalvon ja jäädyttäen sytoplasman .
Kohdistetut lääkkeet
Syövät kasvavat usein hillittömästi, koska he kykenevät kiertämään immuunijärjestelmää. Immunoterapia on menetelmä, joka aktivoi henkilön immuunijärjestelmän ja käyttää sitä omaksi edukseen. Se kehitettiin havaittuaan, että joissakin tapauksissa tapahtui spontaania regressiota. Immunoterapia hyödyntää tätä ilmiötä ja pyrkii rakentamaan ihmisen immuunivasteen syöpäsoluille.
Muut kohdennetut terapialääkkeet estävät kasvutekijöitä, joiden on osoitettu edistävän kasvainten kasvua ja leviämistä. Suurin osa näistä lääkkeistä on hyväksytty viimeisen kymmenen vuoden aikana. Nämä hoidot ovat:
- Nivolumabi
- Aksitinibi
- Sunitinibi
- Cabozantinib
- Everolimus
- Lenvatinib
- Pazopanib
- Bevasitsumabi
- Sorafenib
- Tivotsanibi
- Temsirolimuusi
- Interleukiini-2 (IL-2) on tuottanut "kestäviä remissioita" pienelle osalle potilaista, mutta sillä on huomattava myrkyllisyys.
- Interferoni-a
Potilailla, joilla on metastaattinen syöpä, sunitinibi johtaa todennäköisesti syövän etenemiseen enemmän kuin pembrolitsumabi, aksitinibi ja avelumabi. Verrattuna pembrolitsumabiin ja aksitinibiin se todennäköisesti johtaa enemmän kuolemaan, mutta se voi lievittää hieman vakavia ei -toivottuja vaikutuksia. Verrattuna immunoterapian yhdistelmiin (nivolumabi ja ipilimumabi), sunitinibi voi johtaa etenemiseen ja vakaviin vaikutuksiin. Pazopanibin ja sunitibin välillä ei välttämättä ole juurikaan eroa etenemisessä, eloonjäämisessä ja vakavissa vaikutuksissa.
Aktiivisuutta on raportoitu myös ipilimumabille, mutta se ei ole hyväksytty munuaissyövän lääke.
Lisää lääkkeitä odotetaan saataville lähitulevaisuudessa, koska parhaillaan suoritetaan useita kliinisiä tutkimuksia uusille kohdennetuille hoidoille, mukaan lukien atetsolitsumabi , varlilumabi , durvalumabi , avelumabi , LAG525 , MBG453 , TRC105 ja savolitinibi .
Kemoterapia
Kemoterapia ja sädehoito eivät ole yhtä onnistuneita RCC: n tapauksessa. RCC on resistentti useimmissa tapauksissa, mutta onnistumisprosentti on noin 4–5%, mutta tämä on usein lyhytikäistä, ja kasvaimia ja kasvaimia kehittyy myöhemmin.
Adjuvantti- ja neoadjuvanttihoito
Adjuvanttihoidolla , joka viittaa ensisijaisen leikkauksen jälkeen annettuun hoitoon, ei ole havaittu olevan hyötyä munuaissolusyövässä. Sitä vastoin neoadjuvanttihoitoa annetaan ennen aiottua ensisijaista tai päähoitoa. Joissakin tapauksissa neoadjuvanttihoidon on osoitettu pienentävän RCC: n kokoa ja vaihetta, jolloin se voidaan poistaa kirurgisesti. Tämä on uusi hoitomuoto ja tämän lähestymistavan tehokkuutta arvioidaan edelleen kliinisissä tutkimuksissa .
Metastaasi
Metastaattinen munuaissolukarsinooma (mRCC) on ensisijaisen munuaissolusyövän leviäminen munuaisesta muihin elimiin. 25–30%: lla ihmisistä on tämä metastaattinen leviäminen siihen mennessä, kun heille diagnosoidaan munuaissyöpä. Tämä suuri osuus selittyy sillä, että kliiniset oireet ovat yleensä lieviä, kunnes tauti etenee vakavampaan tilaan. Yleisimpiä etäpesäkkeitä ovat imusolmukkeet, keuhkot, luut, maksa ja aivot. Miten tämä leviäminen vaikuttaa taudin vaiheeseen ja siten ennusteeseen, käsitellään osissa "Diagnoosi" ja "Ennuste".
MRCC: llä on huono ennuste verrattuna muihin syöpiin, vaikka keskimääräinen eloonjäämisaika on pidentynyt viime vuosina hoidon edistymisen vuoksi. Taudin metastaattisen muodon keskimääräinen eloonjäämisaika vuonna 2008 oli alle vuosi ja vuoteen 2013 mennessä se parani keskimäärin 22 kuukauteen. Tästä paranemisesta huolimatta mRCC: n viiden vuoden eloonjäämisaste on alle 10% ja 20–25% kärsivistä ei reagoi kaikkiin hoitoihin, ja näissä tapauksissa tauti etenee nopeasti.
"Hoito" -osiossa käsitellyt saatavilla olevat RCC -hoidot ovat merkityksellisiä myös taudin etäpesäkkeelle. Vaihtoehtoja ovat interleukiini-2, joka on vakiohoito pitkälle edennyttä munuaissolukarsinoomaa varten. Vuosina 2007--2013 on hyväksytty seitsemän uutta hoitoa erityisesti mRCC: lle (sunitinibi, temsirolimuusi, bevasitsumabi, sorafenibi, everolimuusi, pazopanibi ja aksitinibi). Nämä uudet hoidot perustuvat siihen tosiasiaan, että munuaissolukarsinoomat ovat hyvin verisuonikasvaimia - ne sisältävät suuren määrän verisuonia. Lääkkeiden tarkoituksena on estää kasvainten uusien verisuonten kasvua, mikä hidastaa kasvua ja joissakin tapauksissa pienentää kasvainten kokoa. Sivuvaikutukset ovat valitettavasti melko yleisiä näillä hoidoilla ja sisältävät:
- Ruoansulatuskanavan vaikutukset - pahoinvointi, oksentelu, ripuli, ruokahaluttomuus
- Hengityselimet - yskä, hengenahdistus (hengitysvaikeudet)
- Sydän- ja verisuonivaikutukset - hypertensio (korkea verenpaine)
- Neurologiset vaikutukset - kallonsisäinen verenvuoto (verenvuoto aivoihin), tromboosi (verihyytymät) aivoissa
- Vaikutukset ihoon ja limakalvoihin-ihottuma, käsi-jalka -oireyhtymä , stomatiitti
- Luuydinsuppressio - mikä vähentää valkosolujen määrää, lisää infektioiden riskiä ja anemiaa ja vähentää verihiutaleita
- Munuaisvaikutukset - munuaisten vajaatoiminta
- Väsymys.
Sädehoitoa ja kemoterapiaa käytetään yleisemmin RCC: n metastaattisessa muodossa kohdentamaan toissijaiset kasvaimet luissa, maksassa, aivoissa ja muissa elimissä. Vaikka nämä hoidot eivät ole parantavia, ne helpottavat kasvainten leviämiseen liittyviä oireita.
Ennuste
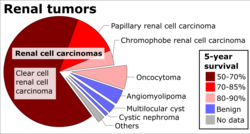
Ennusteeseen vaikuttavat useat tekijät, kuten kasvaimen koko, hyökkäyksen ja etäpesäkkeiden aste, histologinen tyyppi ja ydinaste. Vaihe on tärkein tekijä munuaissolusyövän lopputuloksessa. Seuraavat luvut perustuvat potilaisiin, jotka ensimmäisen kerran diagnosoitiin vuosina 2001 ja 2002 National Cancer -tietokannassa:
| Vaihe | Kuvaus | 5 vuoden eloonjäämisaste |
|---|---|---|
| Minä | Rajoitettu munuaisiin | 81% |
| II | Laajenna munuaiskapselin läpi, rajoittuen Gerotan fasciaan | 74% |
| III | Sisällytä munuaislaskimo tai hilpeät imusolmukkeet | 53% |
| IV | Sisältää kasvaimia, jotka ovat invasiivisia viereisiin elimiin (lisämunuaisia lukuun ottamatta) tai etäisiä etäpesäkkeitä | 8% |
Korealainen tutkimus arvioi sairauskohtaisen yleisen viiden vuoden eloonjäämisasteen 85 prosentiksi. Kaiken kaikkiaan, jos tauti rajoittuu munuaisiin, vain 20–30%: lla kehittyy metastaattinen sairaus munuaisten poiston jälkeen. Tarkempien alaryhmien viiden vuoden eloonjäämisaste on noin 90–95% alle 4 cm: n kasvaimille. Suuremmille kasvaimille, jotka rajoittuvat munuaisiin ilman laskimoiden tunkeutumista, eloonjääminen on edelleen suhteellisen hyvä 80–85%. Kasvaimissa, jotka ulottuvat munuaiskapselin läpi ja paikallisten fascial -investointien ulkopuolelle, eloonjääminen vähenee lähes 60%: iin. Yleinen terveys ja kunto tai niiden oireiden vakavuus vaikuttavat eloonjäämisasteisiin. Esimerkiksi nuoremmilla (20–40 -vuotiailla) tulos on parempi huolimatta siitä, että heillä on enemmän oireita esityksessä, mikä johtuu mahdollisesti syövän leviämisnopeudesta imusolmukkeisiin (vaihe III).
Histologinen luokka liittyy syövän aggressiivisuuteen, ja se on luokiteltu neljään luokkaan, joista yhdellä on paras ennuste (5 vuoden eloonjääminen yli 89%) ja neljällä huonoin ennuste (46% 5 vuoden eloonjäämisestä).
Joillakin ihmisillä munuaissolusyöpä havaitaan ennen oireiden ilmaantumista (sattumalta) CT -skannauksen (Computed Tomography Imaging) tai ultraäänen vuoksi . Satunnaisesti diagnosoitu munuaissolusyöpä (ei oireita) eroaa näkymistään niistä, jotka on todettu munuaissolusyövän tai etäpesäkkeiden oireiden jälkeen. Viiden vuoden eloonjäämisaste oli suurempi satunnaisilla kuin oireisilla kasvaimilla: 85,3% vs 62,5%. Satunnaiset vauriot olivat merkittävästi alempia kuin oireita aiheuttavat, koska 62,1%: lla potilaista, joilla oli satunnainen munuaissolukarsinooma, havaittiin vaiheen I vaurioita, kun taas 23%: lla todettiin oireinen munuaissolukarsinooma.
Jos se on metastasoitunut imusolmukkeisiin, 5 vuoden eloonjääminen on noin 5–15%. Metastasoituneen munuaissolusyövän osalta tekijöitä, joilla voi olla huono ennuste, ovat alhainen Karnofskyn suorituskykypistemäärä (tavallinen tapa mitata toimintahäiriö syöpäpotilailla), alhainen hemoglobiinitaso , korkea seerumin laktaattidehydrogenaasipitoisuus ja korkea korjattu seerumin kalsiumpitoisuus. Ei-metastaattisissa tapauksissa Leibovichin pisteytysalgoritmia voidaan käyttää ennustamaan leikkauksen jälkeinen taudin eteneminen.
Munuaissyöpä on yksi syövistä, jotka liittyvät voimakkaimmin paraneoplastisiin oireyhtymiin , useimmiten johtuen kasvaimen kohdunulkoisen hormonin tuotannosta. Näiden RCC: n komplikaatioiden hoito on yleensä rajoitettua taustalla olevan syövän hoidon lisäksi.
Epidemiologia
Taudin esiintyvyys vaihtelee maantieteellisten, väestöllisten ja vähemmässä määrin perinnöllisten tekijöiden mukaan. Joitakin tunnettuja riskitekijöitä on, mutta muiden mahdollisten riskitekijöiden merkitys on edelleen kiistanalaisempi. Syövän ilmaantuvuus on lisääntynyt maailmanlaajuisesti noin 2–3% vuosikymmenessä viime vuosiin asti, jolloin uusien tapausten määrä on vakiintunut.
RCC -esiintyvyys vaihtelee sukupuolen, iän, rodun ja maantieteellisen sijainnin mukaan ympäri maailmaa. Miehillä esiintyvyys on suurempi kuin naisilla (noin 1,6: 1), ja suurin osa diagnosoidaan 65 vuoden iän jälkeen. Aasialaisilla on raportoitu merkittävästi pienempi RCC -esiintyvyys kuin valkoisilla, ja vaikka Afrikan maissa on pienimmät raportoidut ilmaantuvuudet, afrikkalaisamerikkalaisilla on eniten väestöä Yhdysvalloissa. Kehittyneissä maissa esiintyvyys on korkeampi kuin kehitysmaissa, ja korkeimmat luvut ovat Pohjois -Amerikassa, Euroopassa ja Australiassa / Uudessa -Seelannissa
Historia
Daniel Sennert teki ensimmäisen viittaus viittaa kasvaimen syntyneiden munuaisissa hänen tekstiinsä Practicae Medicinae , julkaistiin ensimmäisen kerran vuonna 1613.
Miril julkaistaan aikaisintaan yksiselitteinen Jos munuaisten syöpä vuonna 1810. Hän kuvaili tapauksessa Françoise vaakatasoon, 35-vuotias nainen, joka esitteli Brest Civic Hospital 6. huhtikuuta 1809 muka loppuvaiheen raskauden.
Koenig julkaisi ensimmäisen munuaiskasvainten luokituksen makroskooppisen morfologian perusteella vuonna 1826.
Hypernephroma kiista
Kasvaimen luokittelun jälkeen tutkijat yrittivät tunnistaa munuaiskarsinooman alkuperäkudoksen.
Patogeneesi Munuaisten kasvaimia keskusteltiin vuosikymmeniä. Keskustelun aloitti Paul Grawitz kun vuonna 1883 hän julkaisi huomautuksensa morfologian pieni, keltainen munuaisten kasvaimia . Grawitz totesi, että vain alveolaariset kasvaimet olivat lisämunuaista , kun taas papillaarikasvaimet olivat peräisin munuaiskudoksesta .
Vuonna 1893 Paul Sudeck haastoi Grawitzin esittämän teorian julkaisemalla kuvauksia munuaiskasvaimista, joissa hän tunnisti munuaistiehyiden epätyypilliset piirteet ja pani merkille näiden epätyypillisten piirteiden porrastuksen tubulusten ja viereisen pahanlaatuisen kasvaimen välillä . Vuonna 1894 Otto Lubarsch , jotka tukivat teorian olettamana Grawitz keksi termin hypernephroid kasvain , joka oli muutettu hypernephroma by Felix Victor Birch-Hirschfeld kuvaamaan näitä kasvaimia.
Oskar Stoerk antoi vuonna 1908 voimakkaan arvostelun Grawitzista, joka piti munuaiskasvainten lisämunuaisen alkuperää todistamattomana . Huolimatta pakottavista väitteistä Grawitzin esittämää teoriaa vastaan, termi hypernephroma ja siihen liittyvä lisämunuaisen konnotaatio säilyivät kirjallisuudessa.
Foot and Humphreys ja Foote et ai. esitteli termin munuaissolukarsinooma korostaakseen munuaisten tubulaarista alkuperää näille kasvaimille . Fetter muutti niiden nimeä hieman nykyään laajalti hyväksytyksi termiksi munuaissolukarsinooma .
Vakuuttavia todisteita keskustelun ratkaisemiseksi tarjosivat Oberling et ai. 1959 opiskellut ultrarakenteeltaan selkeiden solujen kahdeksasta munuaisten karsinoomat . He havaitsivat, että kasvainsolujen sytoplasma sisälsi lukuisia mitokondrioita ja glykogeenin ja rasvan kerrostumia . He tunnistivat sytoplasmisen kalvot, jotka oli asetettu kohtisuoraan pohjakalvoon , satunnaisilla soluilla, jotka sisälsivät mikrovilliä vapaita rajoja pitkin. He päättelivät, että nämä ominaisuudet osoittivat, että kasvaimia syntyi epiteelin soluista munuaisten kiemuratiehyessä , mikä lopulta asettuvat yksi keskusteltu asioista kasvain patologian.
Katso myös
- Staufferin oireyhtymä
- Knudsonin hypoteesi
- Interleukiini-2
- Munuaissyöpä
- Rapamysiini
- Vinblastiini
- Dysuria
- Interferoni
Viitteet
Ulkoiset linkit
| Luokitus | |
|---|---|
| Ulkoiset resurssit |