Seerumin proteiinielektroforeesi - Serum protein electrophoresis
| Seerumin proteiinielektroforeesi | |
|---|---|
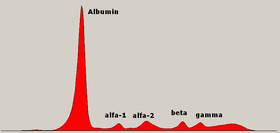 Normaali seerumin proteiinielektroforeesikaavio, jossa on legenda eri vyöhykkeistä.
| |
| MeSH | D001797 |

Seerumiproteiinielektroforeesi ( SPEP tai SPE ) on laboratoriotesti, joka tutkii tiettyjä veren proteiineja, joita kutsutaan globuliiniksi . Yleisimmät indikaatiot seerumiproteiinielektroforeesitestissä ovat multippelin myelooman diagnosointi tai seuranta , monoklonaalinen gammopatia, jonka merkitys on epävarma (MGUS), tai edelleen tutkia eroa matalan albumiinin ja suhteellisen suuren kokonaisproteiinin välillä. Selittämätön luukipu, anemia, proteinuria , krooninen munuaissairaus ja hyperkalsemia ovat myös merkkejä multippelia myeloomaa kohtaan ja indikaatioita SPE: lle. Veri on ensin kerättävä, yleensä ilmatiiviiseen injektiopulloon tai ruiskuun . Elektroforeesi on laboratorio tekniikka, jossa veren seerumin (nesteen Osa verestä sen jälkeen, kun veri on hyytynyt) levitetään joko asetaattimembraani kasteltu nestemäisessä puskurissa, tai puskuroitu agaroosi- geeli matriisi, tai osaksi nesteen kapillaarin putkeen ja altistettiin sähkövirralle seerumin proteiinikomponenttien erottamiseksi viiteen suureen fraktioon koon ja sähkövarauksen mukaan: seerumin albumiini , alfa-1-globuliinit , alfa-2-globuliinit , beeta 1- ja 2-globuliinit ja gamma-globuliinit .
Asetaatti- tai geelielektroforeesi
Proteiinit erotetaan sekä sähkövoimilla että elektroendoosmosteettisilla voimilla. Proteiinin nettovaraus perustuu sen aminohappojen summavaraukseen ja puskurin pH -arvoon. Proteiinit levitetään kiinteään matriisiin, kuten agaroosigeeliin, tai selluloosa -asetaattikalvoon nestemäisessä puskurissa ja sähkövirta syötetään. Negatiivisen varauksen omaavat proteiinit siirtyvät kohti positiivisesti varautunutta anodia. Albumiinilla on negatiivisin varaus, ja se siirtyy kauimmas kohti anodia. Endoosmoottinen virtaus on nesteen liike kohti katodia, mikä saa heikommin varautuneet proteiinit liikkumaan taaksepäin levityskohdasta. Gammaproteiinit erotetaan ensisijaisesti endoosmoottisilla voimilla.
Kapillaarielektroforeesi
Kapillaarielektroforeesissa ei ole kiinteää matriisia. Proteiinit erotetaan pääasiassa voimakkailla elektroendoosmoottisilla voimilla. Näyte ruiskutetaan kapillaariin, jonka pintavaraus on negatiivinen. Suurta virtaa käytetään, ja negatiivisesti varautuneet proteiinit, kuten albumiini, yrittävät liikkua kohti anodia. Nestemäinen puskuri virtaa kohti katodia ja vetää heikommin varautuneita proteiineja.
Seerumin proteiinifraktiot
Albumiini
Albumiini on tärkein osuus normaalissa SPEP: ssä. 30%: n lasku on tarpeen ennen kuin lasku näkyy elektroforeesissa. Yleensä yksi bändi näkyy. Heterotsygoottiset yksilöt voivat tuottaa bisalbuminemiaa - kaksi yhtä värjäävää nauhaa, kahden geenin tuote. Jotkut muunnelmat aiheuttavat laajan vyöhykkeen tai kaksi kaistaa, joiden intensiteetti on epätasainen, mutta mikään näistä vaihtoehdoista ei liity sairauteen. Lisääntynyt anodinen liikkuvuus johtuu bilirubiinin , esteröimättömien rasvahappojen , penisilliinin ja asetyylisalisyylihapon sitoutumisesta ja toisinaan tryptisesta hajoamisesta akuutissa haimatulehduksessa .
Analbuminemiana tunnettu albumiini puuttuu harvoin. Vähentynyt albumiinipitoisuus on kuitenkin yleinen monissa sairauksissa, mukaan lukien maksasairaus , aliravitsemus , imeytymishäiriö, proteiinia menettävä nefropatia ja enteropatia.
Albumiini-alfa-1-vyöhyke
Jopa värjäämällä tällä alueella johtuu alfa-1 lipoproteiini ( high density lipoprotein - HDL). Väheneminen tapahtuu vakavissa tulehduksissa, akuutissa hepatiitissa ja kirroosissa . Myös nefroottinen oireyhtymä voi johtaa albumiinipitoisuuden laskuun; johtuen sen häviämisestä virtsassa vaurioituneen vuotavan glomeruluksen kautta . Lisääntyminen näkyy vaikeilla alkoholisteilla ja naisilla raskauden ja murrosiän aikana.
Korkeat AFP- tasot, joita voi esiintyä maksasolusyövässä, voivat johtaa terävään nauhaan albumiinin ja alfa-1-alueen välillä.
Alfa-1-vyöhyke
Orosomucoidi ja antitrypsiini kulkeutuvat yhdessä, mutta orosomukoidi värjää huonosti, joten alfa-1-antitrypsiini (AAT) muodostaa suurimman osan alfa-1- vyöhykkeestä . Alfa-1-antitrypsiinillä on SG-ryhmä ja tioliyhdisteet voivat sitoutua proteiiniin muuttamalla niiden liikkuvuutta. Vähenevässä tilassa näkyy kaista pienentynyt. Se on vähentynyt nefroottisessa oireyhtymässä ja poissaolo voi osoittaa mahdollisen alfa-1-antitrypsiinin puutteen. Tämä johtaa lopulta keuhkoputkentulehdukseen, joka johtuu säätelemättömästä neutrofiilielastaasiaktiivisuudesta keuhkokudoksessa. Alfa-1-fraktio ei kuitenkaan häviä alfa-1-antitrypsiinin puutteesta, koska myös muut proteiinit, mukaan lukien alfa- lipoproteiini ja orosomukoidi, muuttavat sinne. Positiivisena akuutin vaiheen reaktanttina AAT kasvaa akuutissa tulehduksessa.
Bence Jones -proteiini voi sitoutua alfa-1-vyöhykkeeseen ja hidastaa sitä.
Alfa-1-alfa-2-vyöhyke
Kaksi heikkoa nauhaa voidaan nähdä, jotka edustavat alfa-1-antikymotrypsiiniä ja D - vitamiinia sitovaa proteiinia. Nämä nauhat sulautuvat ja voimistuvat tulehduksen alkuvaiheessa johtuen alfa-1-antikymotrypsiinin, akuutin vaiheen proteiinin, lisääntymisestä .
Alfa-2-alue
Tämä vyöhyke koostuu pääasiassa alfa-2-makroglobuliinista (AMG tai A2M) ja haptoglobiinista . On tyypillisesti alhaisena hemolyyttinen anemia (haptoglobiinin on itsemurha molekyyli, joka sitoutuu vapaan hemoglobiinin vapautuu punasoluja ja nämä kompleksit poistetaan nopeasti fagosyyttien ). Haptoglobiini nousee osana akuutin vaiheen vastetta, mikä johtaa tyypilliseen nousuun alfa-2-alueella tulehduksen aikana. Normaali alfa-2 ja kohonnut alfa-1-alue ovat tyypillisiä maksametastaasien ja kirroosin tyyppejä.
Haptoglobiini/hemaglobiinikompleksit kulkeutuvat enemmän katodisesti kuin haptoglobiini, kuten alfa-2-beeta-interzonissa havaitaan. Tämä nähdään tyypillisesti alfa-2-alueen laajentumisena.
Alfa-2-makroglobuliini voi olla kohonnut lapsilla ja vanhuksilla. Tätä pidetään terävänä etuna alfa-2-kaistalle. AMG nousee merkittävästi (10-kertainen tai suurempi) glomerulaarisen proteiinin menetyksen yhteydessä, kuten nefroottisessa oireyhtymässä . Suuren kokonsa vuoksi AMG ei voi kulkea glomerulusten läpi, kun taas muut pienemmän molekyylipainon proteiinit menetetään. AMG: n tehostettu synteesi selittää sen absoluuttisen lisääntymisen nefroottisessa oireyhtymässä. AMG: n nousua havaitaan myös rotilla, joilla ei ole albumiinia, mikä osoittaa, että tämä on vaste alhaiselle albumiinipitoisuudelle pikemminkin kuin nefroottinen oireyhtymä itse
AMG on lievästi kohonnut diabeettisen nefropatian alkuvaiheessa .
Alfa -2 -beeta -interzone
Kylmään liukenematon globuliini muodostaa tässä nauhan, jota ei näy plasmassa, koska hepariini saostaa sen . Tulehdus on alhainen ja raskauden aikana korkea.
Beeta -lipoproteiini muodostaa epäsäännöllisen kaarevan vyöhykkeen tällä alueella. Korkeat tasot ovat tyypin II hyperkolesterolemiassa , hypertriglyseridemiassa ja nefroottisessa oireyhtymässä.
Beetavyöhyke
Transferriini ja beeta-lipoproteiini ( LDL ) sisältävät beeta-1: n. Lisääntynyt beeta-1-proteiini lisääntyneen vapaan transferriinipitoisuuden vuoksi on tyypillistä raudanpuuteanemialle , raskaudelle ja estrogeenihoidolle . LDL-kohoamisesta johtuva beeta-1-proteiinin lisääntyminen tapahtuu hyperkolesterolemiassa . Vähentynyt beeta-1-proteiini esiintyy akuutissa tai kroonisessa tulehduksessa.
Beeta-2 sisältää C3: n ( komplementtiproteiini 3). Se nousee akuutin vaiheen vasteessa. C3: n masennus tapahtuu autoimmuunisairauksissa, kun komplementtijärjestelmä aktivoituu ja C3 sitoutuu immuunikomplekseihin ja poistuu seerumista. Fibrinogeenia, beeta-2-proteiinia, esiintyy normaalissa plasmassa, mutta sitä ei ole normaalissa seerumissa. Joskus heparinisoiduista potilaista otettu veri ei hyyty kokonaan, jolloin beeta- ja gammaglobuliinien välille muodostuu näkyvä fibrinogeenivyöhyke.
Beeta-gamma-vyöhyke
C-reaktiivista proteiinia löytyy beeta- ja gamma-alueiden välistä, jotka tuottavat beeta/gamma-fuusiota. IgA: lla on eniten anodista liikkuvuutta ja se tyypillisesti kulkee beeta- ja gamma -alueiden välisellä alueella aiheuttaen myös beeta/gamma -fuusion potilailla, joilla on kirroosi, hengitystieinfektio, ihosairaus tai nivelreuma (kohonnut IgA). Fibrinogeeni kohteesta plasma näytteistä nähdään beta gamma alueella. Fibrinogeenia, beeta-2-proteiinia, esiintyy normaalissa plasmassa, mutta sitä ei ole normaalissa seerumissa. Joskus heparinisoiduista potilaista otettu veri ei hyyty kokonaan, jolloin beeta- ja gammaglobuliinien välille muodostuu näkyvä fibrinogeenivyöhyke.
Gamma -alue
Immunoglobuliinit tai vasta-aineet ovat yleensä vain proteiineja normaalissa gamma alueella. Huomattakoon, että kaikki gamma -alueella kulkeutuvat proteiinit värjäytyvät ja näkyvät geelillä, joka voi sisältää proteiinisaasteita, esineitä tai tiettyjä lääkkeitä. Häiriöt vaihtelevat riippuen siitä, käytetäänkö agaroosia vai kapillaarimenetelmää. Immunoglobuliinit koostuvat raskaista ketjuista (IgA, IgM, IgG, IgE ja IgD) ja kevyistä ketjuista (kappa ja lambda). Normaalin gamma -alueen pitäisi näyttää tasaiselta "punastumiselta" tai tahralta ilman epäsymmetriaa tai teräviä piikkejä. Gammaglobuliinit voivat olla kohonneet ( hypergammaglobulinemia ), vähentynyt ( hypogammaglobulinemia ) tai niillä voi olla epänormaali huippu tai piikit. Huomaa, että immunoglobuliineja voi esiintyä myös muilla alueilla; IgA kulkee tyypillisesti beeta-gamma-alueella, ja erityisesti patogeeniset immunoglobuliinit voivat vaeltaa minne tahansa, mukaan lukien alfa-alueet.
Hypogammaglobulinemia on helposti tunnistettavissa gamma -alueen "lamaksi" tai laskuun. Se on normaalia imeväisillä. Sitä esiintyy potilailla, joilla on X-sidottu agammaglobulinemia . IgA -puutetta esiintyy 1: 500 väestöstä, kuten gamma -alueen vaaleus ehdottaa. Huomaa, että hypogammaglobulinema voidaan nähdä MGUS: n tai multippelin myelooman yhteydessä.
Jos gamma -alue osoittaa nousua, ensimmäinen tulkintavaihe on selvittää, onko alue kapea vai leveä. Laaja "paisumainen" tapa (leveä) osoittaa polyklonaalisen immunoglobuliinin tuotannon. Jos se on kohonnut epäsymmetrisesti tai siinä on yksi tai useampia piikkejä tai kapeita "piikkejä", se voi viitata yhden tai useamman immunoglobuliinin klonaaliseen tuotantoon,
Polyklonaalinen gammopatia on osoitettu "turvotuksen kaltaisella" nousulla gamma-alueella, mikä tyypillisesti ilmaisee ei-neoplastisen tilan (vaikka se ei rajoitu ei-neoplastisiin olosuhteisiin). Yleisimmät elektroforeesilla havaitut polyklonaalisen hypergammaglobulinemian syyt ovat vakava infektio , krooninen maksasairaus, nivelreuma, systeeminen lupus erythematosus ja muut sidekudossairaudet.
Kapea piikki viittaa monoklonaaliseen gammopatiaan, joka tunnetaan myös nimellä rajoitettu kaista, tai "M-piikki". Sen varmistamiseksi, että rajoitettu vyöhyke on immunoglobuliini, suoritetaan seurantatestaus immunofiksaatiolla tai immunodisplacement/immunosubraction (kapillaarimenetelmät). Myös terapeuttiset monoklonaaliset vasta -aineet (mAb) kulkeutuvat tällä alueella, ja ne voidaan tulkita väärin monoklonaaliseksi gammopatiaksi, ja ne voidaan myös tunnistaa immunofiksaatiolla tai immunodisplacement/immunosubractionilla, koska ne ovat rakenteellisesti verrattavissa ihmisen immunoglobuliineihin. Yleisin syy rajoitetulle kaistalle on MGUS (monoklonaalinen gammopatia, jonka merkitys on epävarma), joka, vaikkakin välttämätön edeltäjä, etenee vain harvoin multippelia myeloomaa kohtaan. (Keskimäärin 1%/vuosi.) Monoklonaalinen gammopatia on tyypillisesti pahanlaatuinen tai klooninen, ja myelooma on yleisin syy IgA- ja IgG -piikkeihin. krooninen lymfaattinen leukemia ja lymfosarkooma eivät ole harvinaisia ja aiheuttavat yleensä IgM -paraproteiineja . Huomaa, että jopa 8%: lla terveistä geriatrisista potilaista voi olla monoklonaalinen piikki. Waldenströmin makroglobulinemia (IgM), määrittämätön monoklonaalinen gammopatia (MGUS), amyloidoosi, plasmasoluleukemia ja yksinäiset plasmasolut tuottavat myös M-piikin.
Oligoklonaalinen gammopatia on osoitettu yhdellä tai useammalla erillisellä kloonilla.
Lysotsyymiä voidaan pitää gamma -katodinaalina myelomonosyyttisessä leukemiassa , jossa se vapautuu kasvainsoluista .
Viitteet
Ulkoiset linkit
- Proteiinielektroforeesi Lab Tests Online -palvelussa

