Staphylococcus aureus -Staphylococcus aureus
| Staphylococcus aureus | |
|---|---|
|
|
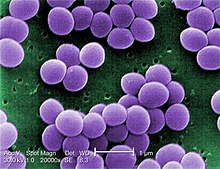
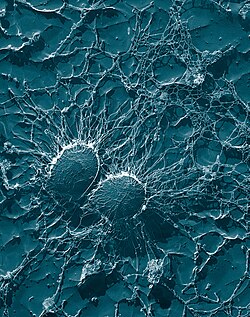
| Skannaava elektronimikroskooppi S. aureuksesta ; väärä väri lisätty | |
|
Tieteellinen luokittelu |
|
| Verkkotunnus: | Bakteerit |
| Pylum: | Yritykset |
| Luokka: | Bacilli |
| Tilaus: | Bacillales |
| Perhe: | Staphylococcaceae |
| Suku: | Staphylococcus |
| Laji: |
S. aureus
|
| Binominen nimi | |
|
Staphylococcus aureus
Rosenbach 1884
|
|
| Staphylococcus aureus | |
|---|---|
| Muut nimet | Staph aureus , S. aureus |
| Erikoisuus | Tarttuva tauti |
| Tyypit | Metisilliinille herkkä Staphylococcus Aureus, metisilliiniresistentti Staphylococcus aureus |
| Syyt | Staphylococcus aureus -bakteerit |
| Differentiaalinen diagnoosi | muut bakteeri-, virus- ja sieni -infektiot, |
| Ehkäisy | käsien pesu, pintojen puhdistaminen |
| Lääkitys | Antibiootit |
| Taajuus | 20-30% ihmisväestöstä usein ilman oireita |
Staphylococcus aureus on Gram-positiivinen pyöreä muotoinen bakteeri , joka kuuluu Firmicutesiin ja on tavallinenkehon mikrobiston jäsen, jota esiintyy usein ylähengitysteissä ja iholla . Se on usein positiivinen katalaasin ja nitraatin pelkistymiselle ja on fakultatiivinen anaerobi, joka voi kasvaa ilman happea. Vaikka S. aureus toimii yleensäihmisen mikrobiston yhteispisteenä , siitä voi tulla myös opportunistinen taudinaiheuttaja , joka on yleinen syy ihoinfektioihin, mukaan lukien paiseet , hengitystieinfektiot , kuten poskiontelotulehdus ja ruokamyrkytys . Patogeenisten kantojen usein edistää infektioita tuottamalla virulenssitekijät kuten voimakas proteiinin myrkkyjä , ja ilmaus solun pinnan proteiini , joka sitoo ja inaktivoi vasta-aineita . Syntyminen antibiooteille vastustuskykyisten kantojen S. aureus , kuten metisilliiniresistentti S. aureus (MRSA) on maailmanlaajuinen ongelma kliinisen lääketieteen . Huolimatta paljon tutkimusta ja kehitystä , eikä rokotetta varten S. aureus on hyväksytty.
Arviolta 20-30% ihmisväestöstä on S. aureuksen pitkäaikaisia kantajia, joita esiintyy osana normaalia ihon kasvistoa , sieraimissa ja naisten alemman lisääntymistiejärjestelmän normaalina asukkaana . S. aureus voivat aiheuttaa erilaisia sairauksia, pienistä ihotulehduksia, kuten akne , märkärupi , paiseet , selluliitti , follikuliitti , carbuncles , kaltattu ihon oireyhtymä , ja paiseet , että hengenvaarallisia sairauksia, kuten keuhkokuume , meningiitti , osteomyeliitti , endokardiitti , toksisen sokin oireyhtymä , bakteremia ja sepsis . Se on edelleen yksi viidestä yleisimpiä syitä sairaalainfektioiden ja on usein syynä haavainfektioita seuraavista leikkauksen . Joka vuosi noin 500 000 potilasta Yhdysvaltain sairaaloissa saa stafylokokki -infektion, pääasiassa S. aureuksen . Jopa 50 000 kuolemaa Yhdysvalloissa vuosittain liittyy S. aureus -infektioihin.
Historia
Löytö
Vuonna 1881 skotlantilainen kirurgi Alexander Ogston havaitsi, että Staphylococcus voi aiheuttaa haavainfektioita havaittuaan bakteeriryhmiä mätässä kirurgisesta paiseesta suorittamansa toimenpiteen aikana. Hän nimesi sen Staphylococcukseksi sen ryhmittynyt ulkonäkö mikroskoopin alla. Sitten vuonna 1884 saksalainen tiedemies Friedrich Julius Rosenbach tunnisti Staphylococcus aureuksen , erottaen sen ja erottamalla sen Staphylococcus albuksesta , sukua olevasta bakteerista. 1930 -luvun alussa lääkärit alkoivat käyttää virtaviivaisempaa testiä S. aureus -infektion havaitsemiseksi koagulaasitestillä , mikä mahdollistaa bakteerin tuottaman entsyymin havaitsemisen. Ennen 1940 -lukua S. aureus -infektiot olivat kuolemaan johtavia useimmilla potilailla. Lääkärit kuitenkin havaitsivat, että penisilliinin käyttö voisi parantaa S. aureus -infektioita. Valitettavasti 1940 -luvun loppuun mennessä penisilliiniresistenssi tuli laajalle levinneeksi tämän bakteeripopulaation keskuudessa ja vastustuskykyisen kannan puhkeamista alkoi esiintyä.
Evoluutio
Staphylococcus aureus voidaan lajitella kymmeneen hallitsevaan ihmislinjaan. Pieniä sukulinjoja on myös lukuisia, mutta niitä ei näy populaatiossa niin usein. Samaan sukuun kuuluvien bakteerien genomit ovat enimmäkseen säilyneitä, lukuun ottamatta liikkuvia geneettisiä elementtejä . S. aureuksessa yleisiä liikkuvia geneettisiä elementtejä ovat bakteriofagit, patogeenisyyssaaret , plasmidit , transposonit ja stafylokokkikasetin kromosomit. Nämä elementit ovat antaneet S. aureukselle mahdollisuuden kehittyä jatkuvasti ja saada uusia piirteitä. On paljon geneettistä vaihtelua sisällä S. aureus lajit . Fitzgeraldin et ai. (2001) paljasti, että noin 22% S. aureus -genomista on koodaamaton ja voi siten vaihdella bakteerikohtaisesti. Esimerkki tästä erosta näkyy lajin virulenssissa. Vain muutama S. aureus -kanta liittyy ihmisten infektioihin. Tämä osoittaa, että lajin sisällä on laaja valikoima tartuntataitoja.
On ehdotettu, että yksi mahdollinen syy lajin suureen heterogeenisuuteen voisi johtua sen riippuvuudesta heterogeenisistä infektioista. Tämä tapahtuu, kun useat eri S. aureus -lajit aiheuttavat infektion isännässä. Eri kannat voivat erittää erilaisia entsyymejä tai tuoda ryhmään erilaisia antibioottiresistenssejä, mikä lisää sen patogeenistä kykyä. Siten tarvitaan suuri määrä mutaatioita ja mobiilien geneettisten elementtien hankintaa.
Toinen merkittävä kehitysprosessi S. aureus -lajissa on sen kehittyminen yhdessä ihmisen isäntien kanssa. Ajan myötä tämä loissuhde on johtanut bakteerin kykyyn kantaa ihmisten nenänielussa aiheuttamatta oireita tai infektioita. Tämä mahdollistaa sen siirtymisen koko ihmispopulaatioon, mikä lisää sen kelpoisuutta lajina. Kuitenkin vain noin 50% ihmisväestöstä on S. aureuksen kantajia , joista 20% on jatkuvia kantajia ja 30% ajoittaisia. Tämä saa tutkijat uskomaan, että monet tekijät määrittävät, kantaako S. aureus oireettomasti ihmisissä, mukaan lukien yksittäiselle henkilölle ominaiset tekijät. Hofmanin ym. Vuonna 1995 tekemän tutkimuksen mukaan näitä tekijöitä voivat olla ikä, sukupuoli, diabetes ja tupakointi. He määrittivät myös joitain geneettisiä muunnelmia ihmisillä, jotka johtivat S. aureuksen lisääntyvään kykyyn asuttaa, erityisesti polymorfismi glukokortikoidireseptorigeenissä, mikä johtaa suurempaan kortikosteroidituotantoon . Yhteenvetona voidaan todeta, että mistä tahansa tämän bakteerin kannasta voi tulla invasiivista, koska tämä riippuu suuresti inhimillisistä tekijöistä.
Vaikka S. aureuksella on nopea lisääntymis- ja mikro-evoluutiovauhti, on olemassa useita esteitä, jotka estävät evoluution lajin kanssa. Yksi tällainen este on AGR, joka on maailmanlaajuinen lisägeenin säätelijä bakteereissa. Tämä säätelijä on yhdistetty bakteerien virulenssitasoon. Toiminnallisten mutaatioiden menetyksen tässä geenissä on havaittu lisäävän sitä sisältävän bakteerin kuntoa. Näin ollen S. aureuksen on tehtävä kompromissi parantaakseen menestystä lajina ja vaihtamalla vähentynyt virulenssi lisääntyneeseen lääkeresistenssiin. Toinen evoluution este on Sau1 -tyypin I rajoitusmuutosjärjestelmä (RM). Tämä järjestelmä suojaa bakteeria vieraalta DNA: lta sulattamalla sen. DNA: n vaihto saman suvun välillä ei ole estetty, koska niillä on samat entsyymit ja RM -järjestelmä ei tunnista uutta DNA: ta vieraana, mutta siirto sukujen välillä estetään.
Mikrobiologia
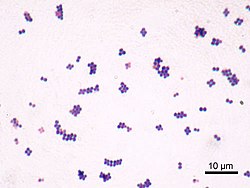
S. aureus ( / ˌ s t æ f ɪ l ə k ɒ k ə s ɔːr i ə s , - l oʊ - / , Kreikka σταφυλόκοκκος, "rypäleen klusterin marja", Latinalaisen aureus , "kultainen") on fakultatiivinen aerobinen , grampositiivinen coccal (pyöreä) bakteeri, joka tunnetaan myös nimellä "kultainen staph" ja "oro staphira". S. aureus ei ole liikkuva eikä muodosta itiöitä . Lääketieteellisessä kirjallisuudessa bakteeria kutsutaan usein nimellä S. aureus , Staph aureus tai Staph a. . S. aureus esiintyy stafylokokkeina (rypäleiden kaltaisia klustereita) mikroskoopin läpi katsottuna, ja sillä on suuria, pyöreitä, kullankeltaisia pesäkkeitä, usein hemolyysillä , kun niitä kasvatetaan veri-agarlevyillä . S. aureus toistetaan suvuttomasti mukaan binaarinen fission . Täydellinen erottaminen tytärsolut välittävät S. aureus autolysiini , ja sen puuttuessa tai kohdennetun esto, tytärsolut jäävät kiinni toisiinsa ja ne näkyvät klustereita.
S. aureus on katalaasipositiivinen (eli se voi tuottaa katalaasientsyymiä). Katalaasi muuttaa vetyperoksidia ( H
2O
2) veteen ja happiin. Katalaasiaktiivisuustestejä käytetään toisinaan stafylokokkien erottamiseen enterokokkeista ja streptokokkeista . Aiemmin S. aureus erotettiin muista stafylokokkeista koagulaasitestillä . Kaikki S. aureus -kannat eivät kuitenkaan ole hyytymispositiivisia, ja virheellinen lajin tunnistaminen voi vaikuttaa tehokkaaseen hoitoon ja torjuntaan.
Staphylococcus eroaa saman nimistä ja lääketieteellisesti merkityksellinen sukuun Streptococcus .
Luonnollinen geneettinen transformaatio on lisääntymisprosessi, johon kuuluu DNA: n siirto bakteerista toiseen väliaineen kautta ja luovuttajasekvenssin integrointi vastaanottajagenomiin homologisen rekombinaation avulla . S. aureuksen havaittiin kykenevän luonnolliseen geneettiseen muuntumiseen, mutta vain harvoin käytetyissä koeolosuhteissa. Lisätutkimukset viittasivat siihen, että luonnollisen geneettisen muutoksen osaamisen kehittyminen voi olla huomattavasti korkeampi sopivissa olosuhteissa, mutta se on vielä löydettävissä.
Rooli terveydessä
Ihmisillä S. aureus voi esiintyä ylähengitysteissä, suolen limakalvolla ja iholla normaalin mikrobiston jäsenenä . Kuitenkin, koska S. aureus voi aiheuttaa sairauden tietyissä isäntä- ja ympäristöolosuhteissa, sitä luonnehditaan "patobiontiksi".
Rooli sairaudessa

Vaikka S. aureus toimii yleensä kommensalbakteerina , oireettomasti kolonisoimalla noin 30% ihmisväestöstä, se voi joskus aiheuttaa sairauksia. Erityisesti S. aureus on yksi yleisimmistä bakteerien ja tarttuvan endokardiitin syistä . Lisäksi se voi aiheuttaa erilaisia iho- ja pehmytkudosinfektioita , erityisesti silloin, kun iho- tai limakalvoesteet on rikottu.
S. aureus -infektioita voi levitä kosketuksen kautta mätä infektoituneen haavan, ihon ja ihon kanssa kosketuksiin tartunnan saaneen henkilön, ja kosketuksessa esineiden käyttää tartunnan saaneen henkilön, kuten pyyhkeet, lakanat, vaatteet, tai urheiluvälineet. Nivelenvaihdot asettavat henkilön erityiseen riskiin septiseen niveltulehdukseen , stafylokokki -endokardiittiin (sydänläppien infektio) ja keuhkokuumeeseen .
Ennaltaehkäiseviin toimenpiteisiin kuuluu käsien pesu usein saippualla ja uiminen tai suihku päivittäin.
S. aureus on merkittävä syy kroonisiin biofilmi -infektioihin lääketieteellisissä implantteissa , ja toksiinien tukahduttaja on osa infektioreittiä.
S. aureus voi levätä kehossa vuosia huomaamatta. Kun oireet alkavat näkyä, isäntä on tarttuva vielä kahden viikon ajan ja yleinen sairaus kestää muutaman viikon. Hoitamattomana tauti voi kuitenkin olla tappava. Syvästi tunkeutuvat S. aureus -infektiot voivat olla vakavia.
Ihon infektiot
Ihoinfektiot ovat yleisin S. aureus -infektion muoto. Tämä voi ilmetä eri tavoin, mukaan lukien pienet hyvänlaatuiset paiseet , follikuliitti , impetigo , selluliitti ja vaikeammat, invasiiviset pehmytkudosinfektiot.
S. aureus on erittäin yleinen henkilöillä, joilla on atooppinen ihottuma , yleisemmin tunnettu ekseema. Sitä esiintyy enimmäkseen hedelmällisissä, aktiivisissa paikoissa, mukaan lukien kainalot, hiukset ja päänahka. Näillä alueilla esiintyvät suuret näppylät voivat pahentaa infektiota, jos ne repeytyvät. Tämä voi johtaa stafylokokki -palovamman iho -oireyhtymään , jonka vakava muoto näkyy vastasyntyneillä .
Läsnäolon S. aureus henkilöillä, joilla on atooppinen ihottuma ei ole viitteitä hoitoon oraalisilla antibiooteilla, kuten ei ole myöskään osoittanut, että tämä antaa hyötyä potilaalle. Kuitenkin, paikallisilla antibiooteilla yhdessä kortikosteroidien on todettu tilan parantamiseksi. S. aureuksen kolonisaatio ajaa atooppisen ihottuman tulehdusta; S. aureuksen uskotaan hyödyntävän atooppista ihottumaa sairastavien ihosuojan puutteita, laukaiseen sytokiinien ilmentymisen ja pahentavan siten oireita.
Ruoka myrkytys
S. aureus on myös vastuussa ruokamyrkytyksestä . Se pystyy tuottamaan myrkkyjä, jotka aiheuttavat ruokamyrkytyksen ihmiskehossa. Sen itämisaika kestää yhdestä kuuteen tuntiin, ja itse sairaus kestää 30 minuutista 3 päivään. Ennaltaehkäiseviin toimenpiteisiin taudin leviämisen estämiseksi kuuluu käsien pesu huolellisesti saippualla ja vedellä ennen ruoan valmistamista. Pysy kaukana kaikesta ruoasta, jos olet sairas, ja käytä käsineitä, jos käsissä tai ranteissa on avoimia haavoja ruoan valmistuksen aikana. Jos säilytät ruokaa yli 2 tuntia, pidä ruoka alle 40 ° C: ssa tai yli 4,4 tai 60 ° C: ssa.
Luu- ja niveltulehdukset
S. aureus on bakteeri, joka on yleisesti vastuussa kaikista tärkeimmistä luu- ja nivelinfektioista. Tämä ilmenee yhdessä kolmesta muodosta: osteomyeliitti , septinen niveltulehdus ja korvaava nivelleikkaus.
Bakteeria
S. aureus on johtava syy verenkiertotulehduksiin suuressa osassa teollistunutta maailmaa. Infektioon liittyy yleensä ihon tai limakalvojen taukoja, jotka johtuvat leikkauksesta, vammasta tai suonensisäisten laitteiden, kuten katetrien , hemodialyysikoneiden tai injektoitujen lääkkeiden käytöstä. Kun bakteerit ovat tulleet verenkiertoon, ne voivat tartuttaa erilaisia elimiä aiheuttaen tarttuvan endokardiitin , septisen niveltulehduksen ja osteomyeliitin . Tämä tauti on erityisen yleinen ja vakava hyvin nuorilla ja hyvin vanhoilla.
Ilman antibioottihoitoa S. aureus -bakteremian kuolleisuus on noin 80%. Antibioottihoidolla kuolleisuus vaihtelee 15%: sta 50%: iin potilaan iästä ja terveydestä sekä S. aureus -kannan antibioottiresistenssistä riippuen .
Lääketieteelliset implantti -infektiot
S. aureusta esiintyy usein biofilmeissä, jotka on muodostettu kehoon tai ihmiskudokseen istutetuille lääkinnällisille laitteille. Se löytyy yleisesti toisen patogeenin, Candida albicansin kanssa , muodostaen monilajisia biokalvoja. Jälkimmäisen epäillään auttavan S. aureusta tunkeutumaan ihokudokseen. Korkeampi kuolleisuus liittyy monilajisiin biofilmeihin.
S. aureus -biokalvo on vallitseva syy ortopedisiin implantteihin liittyviin infektioihin, mutta sitä esiintyy myös sydänimplantteissa, verisuonisiirrännäisissä , erilaisissa katetreissa ja kosmeettisissa kirurgisissa implantteissa. Implantaation jälkeen näiden laitteiden pinta päällystetään isäntäproteiineilla, jotka tarjoavat runsaan pinnan bakteerien kiinnittymiselle ja biokalvon muodostumiselle. Kun laite on saanut tartunnan, se on poistettava kokonaan, koska S. aureus -kalvoa ei voida tuhota antibioottihoidolla.
Nykyinen hoito S. aureus biofilm -välitteisille infektioille sisältää tartunnan saaneen laitteen kirurgisen poiston ja sen jälkeen antibioottihoidon. Perinteinen antibioottihoito yksin ei ole tehokas tällaisten infektioiden hävittämisessä. Vaihtoehto leikkauksen jälkeiselle antibioottihoidolle on antibioottikuormitettujen, liukenevien kalsiumsulfaattihelmien käyttö, jotka istutetaan lääketieteelliseen laitteeseen. Nämä helmet voivat vapauttaa suuria antibioottiannoksia haluttuun kohtaan alkuperäisen infektion estämiseksi.
S. aureus -biofilmin uusia hoitoja, joihin liittyy nanohopeapartikkeleita, bakteriofageja ja kasviperäisiä antibiootteja, tutkitaan. Nämä aineet ovat osoittaneet estovaikutuksia biokalvoihin upotettua S. aureusta vastaan . Eräällä entsyymiluokalla on havaittu olevan biofilmin matriisia hajottava kyky, joten niitä voidaan käyttää biofilmin hajotusaineina yhdessä antibioottien kanssa.
Eläinten infektiot
S. aureus voi selviytyä koirilla, kissoilla ja hevosilla ja voi aiheuttaa kimalaisia kanoissa. Jotkut uskovat, että terveydenhuollon työntekijöiden koiria on pidettävä merkittävänä antibioottiresistentin S. aureuksen lähteenä , varsinkin epidemian aikana. Boostin, O'Donoghuen ja Jamesin vuonna 2008 tekemässä tutkimuksessa havaittiin, että vain noin 90% S. aureuksesta oli kolonisoitu lemmikkikoirissa, jotka esitettiin resistentteinä vähintään yhdelle antibiootille. Nenän alue on katsottu tärkeimmäksi siirtokohteeksi koirien ja ihmisten välillä.
S. aureus on yksi lypsylehmien utaretulehduksen aiheuttajista . Sen suuri polysakkaridikapseli suojaa organismia lehmän immuunipuolustukselta .
Virulenssitekijät
Entsyymit
S. aureus tuottaa erilaisia entsyymejä, kuten koagulaasia (sitoutuneita ja vapaita koagulaaseja), jotka hyytyvät plasmaan ja päällystävät bakteerisolun todennäköisesti fagosytoosin estämiseksi . Hyaluronidaasi (tunnetaan myös leviämistekijänä) hajottaa hyaluronihapon ja auttaa levittämään sitä. Deoksiribonukleaasi , joka hajottaa DNA, suojaa S. aureus peräisin neutrofiili solunulkoisia ansaan -välitteisen tappamisen. S. aureus tuottaa myös lipaasia lipidien pilkkomiseen, stafylokinaasia fibriinin liuottamiseen ja leviämisen helpottamiseen sekä beetalaktamaasia lääkeresistenssiin.
Myrkyt
Kannasta riippuen S. aureus kykenee erittämään useita eksotoksiineja , jotka voidaan luokitella kolmeen ryhmään. Monet näistä myrkkyistä liittyvät tiettyihin sairauksiin.
- Superantigens
- Antigeenejä kutsutaan superantigeenien voi aiheuttaa toksinen sokkioireyhtymä (TSS). Tämä ryhmä käsittää 25 stafylokokki enterotoksigeenisistä (SE), joka on tähän mennessä identifioitu ja nimetty aakkosjärjestyksessä (SEA - SEZ), mukaan lukien enterotoksiini B-tyypin sekä toksisen sokkioireyhtymän toksiini TSST-1 , joka aiheuttaa TSS liittyy tamponin käyttöön. Myrkyllisen sokin oireyhtymälle on ominaista kuume , punoittava ihottuma , matala verenpaine , sokki , useiden elinten vajaatoiminta ja ihon kuorinta . TSST-1-vasta-aineen puute vaikuttaa TSS: n patogeneesiin. Muut S. aureus -kannat voivat tuottaa enterotoksiinia, joka on gastroenteriitin tyypin aiheuttaja . Tämä gastroenteriitin muoto on itsestään rajoittuva, ja sille on ominaista oksentelu ja ripuli 1–6 tuntia toksiinin nauttimisen jälkeen, ja toipuminen 8–24 tunnissa. Oireita ovat pahoinvointi, oksentelu, ripuli ja suuri vatsakipu.
- Kuorivat toksiinit
- Exfoliatiiviset toksiinit ovat eksotoksiineja, jotka liittyvät taudin stafylokokki -palovamma -oireyhtymään (SSSS), joka esiintyy yleisimmin imeväisillä ja pikkulapsilla. Sitä voi esiintyä myös epidemioina sairaalan päiväkodeissa. Proteaasin aktiivisuus hilseilevä toksiinien aiheuttaa kuorinta ihon havaittu SSSS.
- Muut toksiinit
- Stafylokokki -toksiinit, jotka vaikuttavat solukalvoihin, sisältävät alfa -toksiinin , beetatoksiinin , delta -toksiinin ja useita kaksikomponenttisia toksiineja. Kantoja S. aureus voi isännöidä faagit , kuten profaagi Φ-PVL joka tuottaa Panton-Valentine Leukosidi (PVL), lisätä virulenssi . Kaksikomponenttinen toksiini PVL liittyy vakavaan nekroottiseen keuhkokuumeeseen lapsilla. PVL: n komponentteja koodaavat geenit koodataan yhteisöön liittyvissä MRSA-kannoissa esiintyvällä bakteriofagilla .
Pieni RNA
Luettelo pienistä RNA: ista, jotka osallistuvat bakteerien virulenssin hallintaan S. aureuksessa, kasvaa. Tätä voivat helpottaa tekijät, kuten lisääntynyt biokalvonmuodostus tällaisten pienten RNA: iden lisääntyneen tason läsnä ollessa. Esimerkiksi RNAIII , SprD , SprC, RsaE , SprA1, SSR42, ArtR, SprX ja Teg49 .
Transkription jälkeisen sääntelyn strategiat 3'-kääntämättömän alueen mukaan
Monet mRNA: iden in S. aureus kantaa kolme prime transloimattomia alueita (3'UTR) pitempi kuin 100 nukleotidiä , joka voi mahdollisesti olla säätelytoiminto.
I caR mRNA: n lisätutkimus (mRNA, joka koodaa bakteerien biokalvomatriisin pääekspolysacharidisen yhdisteen repressoria) osoitti, että 3'UTR: n sitoutuminen 5' -UTR: ään voi häiritä translaation aloituskompleksia ja tuottaa kaksisäikeisen substraatin RNaasille III . Vuorovaikutus on 3'UTR: n UCCCCUG-motiivin ja 5'UTR: n Shine-Dalagarnon alueen välillä. Kuvion poistaminen johti IcaR -repressorin kertymiseen ja biofilmin kehityksen estämiseen. Biokalvon muodostuminen on tärkein syy Staphylococcus -implantti -infektioihin.
Biofilmi
Biokalvot ovat mikro -organismiryhmiä , kuten bakteereja, jotka kiinnittyvät toisiinsa ja kasvavat märillä pinnoilla. S. aureus biofilmi on upotettu glykokalyksin liejukerroksen ja voi koostua teikkohapoksi happojen, isäntä proteiineja, ekstrasellulaarista DNA: ta (Edna) ja polysakkaridi solujen välisen antigeeni (PIA). Kaikki S. aureus -kalvot eivät sisällä PIA: ta. S. aureus -kalvot ovat tärkeitä sairauden patogeneesissä, koska ne voivat edistää antibioottiresistenssiä ja immuunijärjestelmän kiertämistä. S. aureus -biofilmi vastustaa hyvin antibioottihoitoja ja isännän immuunivastetta. Yksi hypoteesi tämän selittämiseksi on, että biokalvomatriisi suojaa upotettuja soluja toimimalla esteenä estämään antibioottien tunkeutumisen. Biokalvomatriisi koostuu kuitenkin monista vesikanavista, joten tämä hypoteesi on yhä epätodennäköisempi, mutta biokalvomatriisi sisältää mahdollisesti antibiootteja hajottavia entsyymejä, kuten β-laktamaaseja, jotka voivat estää antibioottien tunkeutumisen. Toinen hypoteesi on, että olosuhteet biofilmin matriisissa suosivat pysyvien solujen muodostumista , jotka ovat erittäin antibioottiresistenttejä, lepotilassa olevia bakteerisoluja. S. aureus -biofilmeillä on myös korkea vastustuskyky isännän immuunivastetta vastaan. Vaikka resistenssin tarkkaa mekanismia ei tunneta, S. aureus -kalvojen kasvu on lisääntynyt isännän immuunivasteen tuottamien sytokiinien läsnä ollessa . Isäntävasta -aineet ovat vähemmän tehokkaita S. aureus -biofilmin suhteen heterogeenisen antigeenijakauman vuoksi , jossa antigeeni voi olla läsnä joillakin biofilmin alueilla, mutta ei lainkaan muilta alueilta.
Biofilmin kehitystutkimukset ovat osoittaneet liittyvän geeniekspression muutoksiin. On olemassa tiettyjä geenejä, joiden todettiin olevan ratkaisevia biofilmin eri kasvuvaiheissa. Kaksi näistä geeneistä sisältää rocD: n ja gudB: n, jotka koodaavat entsyymin ornitiini-oksohappotransaminaasia ja glutamaattidehydrogenaasia, jotka ovat tärkeitä aminohappojen aineenvaihdunnalle. Tutkimukset ovat osoittaneet, että biofilmin kehitys perustuu aminohappoihin glutamiiniin ja glutamaattiin, jotta aineenvaihdunta toimisi kunnolla.
Muut immunovasiiviset strategiat
- Proteiini A
Proteiini A on ankkuroitu stafylokokki peptidoglykaani pentaglycine sillat (ketjut viiden glysiinin tähdettä), jonka transpeptidaasientsyymin sortase A-proteiini, IgG : tä sitovan proteiinin, sitoutuu Fc-alueeseen , joka vasta-aine . Itse asiassa tutkimukset, jotka koskivat proteiini A: ta koodaavien geenien mutaatiota, johtivat S. aureuksen virulenssin vähenemiseen mitattuna veren eloonjäämisellä, mikä on johtanut spekulaatioihin, että proteiini A: n aiheuttama virulenssi vaatii vasta-aineen Fc-alueiden sitoutumista.
A -proteiinia eri rekombinanttimuodoissa on käytetty vuosikymmenien ajan useiden vasta -aineiden sitomiseen ja puhdistamiseen immunoaffiniteettikromatografialla . Transpeptidaaseja, kuten sortaaseja, jotka ovat vastuussa tekijöiden, kuten proteiinin A, kiinnittämisestä stafylokokkin peptidoglykaaniin, tutkitaan toivoen uusien antibioottien kehittämistä MRSA -infektioiden torjumiseksi.
- Stafylokokkipigmentit
Joitakin kantoja S. aureus pystyvät tuottamaan staphyloxanthin - kultainen värinen karotenoidia pigmentti . Tämä pigmentti toimii virulenssitekijänä , pääasiassa olemalla bakteerien antioksidantti, joka auttaa mikrobia välttämään reaktiivisia happilajeja, joita isäntä immuunijärjestelmä käyttää taudinaiheuttajien tappamiseen.
S. aureuksen mutanttikannat, jotka on modifioitu puuttumaan stafyloksantiinista, eivät todennäköisesti selviä inkubaatiosta hapettavan kemikaalin, kuten vetyperoksidin , kanssa kuin pigmentoituneet kannat. Mutanttipesäkkeet kuolevat nopeasti altistuessaan ihmisen neutrofiileille , kun taas monet pigmentoituneet pesäkkeet selviävät. Hiirillä pigmentoituneet kannat aiheuttavat viipyviä paiseita, kun ne siirretään haavoihin, kun taas pigmenttien kantojen tartuttamat haavat paranevat nopeasti.
Nämä testit viittaavat siihen, että Staphylococcus -kannat käyttävät stafyloksantiinia puolustuksena normaalia ihmisen immuunijärjestelmää vastaan. Lääkkeet, jotka on suunniteltu estämään stafyloksantiinin tuotantoa, voivat heikentää bakteeria ja uudistaa sen herkkyyttä antibiooteille. Itse asiassa stafyloksantiinin ja ihmisen kolesterolin biosynteesireittien samankaltaisuuksien vuoksi kolesterolia alentavan hoidon yhteydessä kehitetyn lääkkeen osoitettiin estävän S. aureus -pigmentaatiota ja sairauden etenemistä hiiren infektiomallissa .
Klassinen diagnoosi
Riippuen infektion tyypistä, asianmukainen näyte saadaan vastaavasti ja lähetetään laboratorioon lopullista tunnistamista varten käyttämällä biokemiallisia tai entsyymipohjaisia testejä. Gram-värjäys suoritetaan ensin ohjata tavalla, joka olisi osoitettava tyypillinen gram-positiiviset bakteerit, kokit, klustereissa. Toiseksi isolaattia viljellään mannitolisuola-agarilla , joka on selektiivinen elatusaine, jossa on 7,5% NaCl: a ja joka sallii S. aureuksen kasvun, tuottaen keltaisia pesäkkeitä mannitolifermentaation ja sen jälkeen lasketun väliaineen pH: n seurauksena .
Lisäksi lajitason erilaistamiseksi katalaasi (positiivinen kaikille Staphylococcus -lajeille), koagulaasi ( fibriinihyytymän muodostuminen, positiivinen S. aureukselle ), DNAase (puhdistuma -alue DNaasi -agarilla), lipaasi (keltainen väri ja pilaantunut haju ), ja fosfataasitestit (vaaleanpunainen väri) suoritetaan. Stafylokokin ruokamyrkytykselle voidaan suorittaa faagityyppi sen määrittämiseksi, olivatko ruoasta saadut stafylokokit infektion lähde.
Nopea diagnoosi ja kirjoittaminen
Lääkäri tiedustelee viimeaikaisia toimintoja ja ruokaa, joita potilas on äskettäin syönyt, ja fyysinen tutkimus suoritetaan oireiden tarkistamiseksi. Vakavampien oireiden yhteydessä verikokeet ja ulosteviljely voivat olla kunnossa. Diagnostiset mikrobiologiset laboratoriot ja vertailulaboratoriot ovat avainasemassa S. aureus -epidemioiden ja uusien kantojen tunnistamisessa . Viimeaikainen geneettinen kehitys on mahdollistanut luotettavat ja nopeat tekniikat S. aureuksen kliinisten isolaattien tunnistamiseksi ja karakterisoimiseksi reaaliajassa. Nämä työkalut tukevat infektioiden torjuntastrategioita bakteerien leviämisen rajoittamiseksi ja antibioottien asianmukaisen käytön varmistamiseksi. Kvantitatiivista PCR: ää käytetään yhä enemmän infektioiden puhkeamiseen.
Tarkasteltaessa S. aureuksen kehittymistä ja sen kykyä sopeutua kuhunkin modifioituun antibioottiin käytetään kahta perusmenetelmää, jotka tunnetaan nimellä "bändipohjainen" tai "sekvenssipohjainen". Kun nämä kaksi menetelmää pidetään mielessä, muita menetelmiä, kuten monitarkennussekvenssityyppiä (MLST), pulssikenttägeelielektroforeesia (PFGE), bakteriofagityyppiä , kylpylälokityyppiä ja SCCmec-kirjoittamista, käytetään usein enemmän kuin muita. Näillä menetelmillä voidaan määrittää, mistä MRSA -kannat ovat peräisin ja missä ne ovat tällä hetkellä.
MLST: ssä tämä kirjoitustekniikka käyttää fragmentteja useista taloudenhoitogeeneistä, jotka tunnetaan nimellä aroE, glpF, gmk, pta, tip ja yqiL . Näille sekvensseille annetaan sitten numero, joka antaa useiden numeroiden merkkijonon, joka toimii alleeliprofiilina. Vaikka tämä on yleinen menetelmä, tämän menetelmän rajoitus on mikroalustan ylläpito, joka havaitsee uudet alleeliprofiilit, mikä tekee siitä kalliin ja aikaa vievän kokeen.
PFGE -menetelmällä, jota käytetään edelleen paljon 1980 -luvun ensimmäisellä menestyksellä, pystytään edelleen auttamaan erottamaan MRSA -isolaatit. Tämän saavuttamiseksi tekniikka käyttää useita geelelektroforeeseja sekä jännitegradienttia molekyylien selkeiden resoluutioiden näyttämiseksi. S. aureus fragmentit siirtyvät sitten alas geeli, tuottaa tietyllä taajuusalueella, kuvioita, jotka myöhemmin verrattuna muihin isolaattien toiveita tunnistamiseksi läheisten kantojen. Menetelmän rajoituksia ovat käytännön vaikeudet yhtenäisten nauhakuvioiden ja PFGE -herkkyyden kannalta kokonaisuutena.
Spa -lokuksen kirjoittamista pidetään myös suosituna tekniikkana, jossa käytetään yhtä lokusvyöhykettä S. aureuksen polymorfisella alueella kaikenlaisten mutaatioiden erottamiseksi. Vaikka tämä tekniikka on usein halpaa ja vähemmän aikaa vievää, mahdollisuus syrjivän voiman menettämiseen, mikä vaikeuttaa MLST-kloonikompleksien erottamista toisistaan, on tärkeä rajoitus.
Hoito
Herkkien kantojen osalta S. aureus -infektion ensisijainen hoito on penisilliini . Antibiootti, joka on peräisin joistakin Penicillium- sienilajeista , penisilliini estää peptidoglykaanien ristisidosten muodostumista, jotka tarjoavat jäykkyyttä ja lujuutta bakteerisoluseinässä . Penisilliinin 4-jäseninen β-laktaamirengas sitoutuu entsyymiin DD-transpeptidaasi , entsyymi, joka toiminnallisesti silloittaa peptidoglykaaniketjut, jotka muodostavat bakteerisoluseinät. P-laktaamin sitoutuminen DD-transpeptidaasiin estää entsyymin toimivuuden eikä se voi enää katalysoida ristisidosten muodostumista. Tämän seurauksena soluseinän muodostuminen ja hajoaminen ovat epätasapainossa, mikä johtaa solukuolemaan. Useimmissa maissa penisilliiniresistenssi on kuitenkin erittäin yleinen (> 90%), ja ensilinjan hoito on yleisimmin penisillinaasiresistentti beetalaktaamiantibiootti (esimerkiksi oksasilliini tai flukloksasilliini , joilla molemmilla on sama vaikutusmekanismi) penisilliininä) tai vankomysiininä paikallisten resistenssimallien mukaan. Yhdistelmähoitoa gentamysiinin kanssa voidaan käyttää vakavien infektioiden, kuten endokardiitin , hoitoon , mutta sen käyttö on kiistanalaista munuaisvaurioiden suuren riskin vuoksi. Hoidon kesto riippuu infektiokohdasta ja vakavuudesta. Rifampisiinia on käytetty historiallisesti S aureus -bakteerian hoidossa, mutta satunnaistetut kontrolloidut tutkimustulokset ovat osoittaneet, ettei tästä ole mitään hyötyä tavanomaiseen antibioottihoitoon verrattuna.
Antibioottiresistenssin S. aureus oli harvinaista, kun penisilliini otettiin ensimmäisen kerran käyttöön vuonna 1943. Itse asiassa alkuperäisen petrimalja johon Alexander Fleming ja Imperial College London havaittu antibakteerinen aktiivisuus Penicillium sieni kasvoi kulttuurin S. aureus . Vuoteen 1950 mennessä 40% sairaalan S. aureus -isolaateista oli penisilliiniresistenttejä; vuoteen 1960 mennessä se oli noussut 80 prosenttiin.
Metisilliiniresistentti Staphylococcus aureus (MRSA, usein lausutaan / m ɜːr s ə / tai / ɛ m ɑːr ɛ s eɪ / ), on yksi useista suuresti pelättävissä kantoja S. aureus , jotka ovat tulleet resistenteiksi useimmat β-laktaami antibiootteja. Tästä syystä vankomysiiniä , glykopeptidiantibioottia , käytetään yleisesti MRSA: n torjuntaan. Vankomysiini estää peptidoglykaanin synteesiä, mutta toisin kuin β-laktaamiantibiootit, glykopeptidiantibiootit kohdistuvat ja sitoutuvat soluseinän aminohappoihin estäen peptidoglykaanien ristisidosten muodostumisen. MRSA-kantoja esiintyy useimmiten sairaaloiden kaltaisissa laitoksissa, mutta ne ovat yhä yleisempiä yhteisön hankkimissa infektioissa.
Pieniä ihoinfektioita voidaan hoitaa kolminkertaisella antibioottivoiteella . Yksi ajankohtainen lääke, jota määrätään, on Mupirocin, proteiinisynteesin estäjä, jota Pseudomonas fluorescens tuottaa luonnollisesti ja joka on menestynyt S. aureus -nenäkärryn hoidossa.
Antibioottinen vastustuskyky
Stafylokokkiresistenssi penisilliinille johtuu penisillinaasin ( beetalaktamaasin erään muodon ) tuotannosta: entsyymistä, joka pilkkoo penisilliinimolekyylin beetalaktaamirenkaan ja tekee antibiootista tehottoman. Penisillinaasi-resistenttejä β-laktaamiantibiootteja, kuten metisilliini , nafsilliini , oksasilliini , kloksasilliini , dikloksasilliini , ja flukloksasilliini pystyvät vastustamaan hajoamista stafylokokki penisillinaasi.
Resistenssi metisilliinille välitetään mec -operonin kautta , joka on osa stafylokokkikasetin kromosomia mec (SCC mec ). SCCmec on liikkuvien geneettisten elementtien perhe, joka on S. aureuksen evoluution merkittävä liikkeellepaneva voima . Resistenssin antaa mecA- geeni, joka koodaa muuttunutta penisilliiniä sitovaa proteiinia (PBP2a tai PBP2 '), jolla on pienempi affiniteetti β-laktaamien (penisilliinit, kefalosporiinit ja karbapeneemit ) sitomiseen . Tämä mahdollistaa resistenssin kaikille β-laktaamiantibiooteille ja estää niiden kliinisen käytön MRSA-infektioiden aikana. Tutkimukset ovat selittäneet, että tämä mobiili geneettinen elementti on hankittu eri linjoilla eri geenisiirtotapahtumissa, mikä osoittaa, että eri MRSA -kantojen yhteistä esi -isää ei ole. Mielenkiintoista on, että yksi tutkimus viittaa siihen, että MRSA uhraa virulenssin, esimerkiksi toksiinituotannon ja invasiivisuuden, selviytyäkseen ja biokalvojen luomiseksi
Aminoglykosidiantibiootit , kuten kanamysiini , gentamysiini , streptomysiini , olivat kerran tehokkaita stafylokokki -infektioita vastaan, kunnes kantoihin kehittyi mekanismeja aminoglykosidien toiminnan estämiseksi, mikä tapahtuu protonoidun amiinin ja/tai hydroksyyli -vuorovaikutuksen kautta 30S -ribosomaalisen alayksikön ribosomaalisen RNA : n kanssa . Aminoglykosidiresistenssimekanismien kolme päämekanismia ovat tällä hetkellä ja laajalti hyväksyttyjä: aminoglykosidia muuttavat entsyymit, ribosomaaliset mutaatiot ja lääkkeen aktiivinen ulosvirtaus bakteereista.
Aminoglykosidia muuttavat entsyymit inaktivoivat aminoglykosidin kiinnittämällä kovalenttisesti joko fosfaatti- , nukleotidi- tai asetyyliryhmän joko antibiinin amiiniin tai alkoholin avainfunktionaaliseen ryhmään (tai molempiin ryhmiin). Tämä muuttaa varausta tai estää steerisesti antibioottia vähentäen sen ribosomaalista sitoutumisaffiniteettia. On S. aureus , parhaiten tunnettu aminoglykosidi-modifioivan entsyymin on aminoglykosidi adenylyltransferase 4' IA ( ANT (4' ) IA ). Tämä entsyymi on ratkaistu röntgenkristallografialla . Entsyymi pystyy kiinnittämään adenyyliryhmän monien aminoglykosidien, mukaan lukien kamamysiini ja gentamisiini, 4' -hydroksyyliryhmään.
Glykopeptidiresistenssi välitetään hankkimalla vanA -geeni, joka on peräisin Tn1546 -transposonista , joka löytyy enterokokkien plasmidista ja koodaa entsyymiä, joka tuottaa vaihtoehtoisen peptidoglykaanin , johon vankomysiini ei sitoudu.
Nykyään S. aureuksesta on tullut resistentti monille yleisesti käytetyille antibiooteille. Yhdistyneessä kuningaskunnassa vain 2% kaikista S. aureus -isolaateista on herkkiä penisilliinille, ja sama kuva on muualla maailmassa. Β-laktamaasille resistentit penisilliinit (metisilliini, oksasilliini, kloksasilliini ja flukloksasilliini) kehitettiin penisilliiniresistentin S. aureuksen hoitoon , ja niitä käytetään edelleen ensilinjan hoitona. Metisilliini oli tämän luokan ensimmäinen antibiootti, jota käytettiin (se otettiin käyttöön vuonna 1959), mutta vain kaksi vuotta myöhemmin ensimmäinen tapaus metisilliiniresistentistä Staphylococcus aureuksesta (MRSA) raportoitiin Englannissa.
Tästä huolimatta MRSA pysyi yleensä harvinaisena havaintona jopa sairaalaympäristössä 1990 -luvulle asti, jolloin MRSA -esiintyvyys sairaaloissa räjähti ja on nyt endeeminen .
MRSA-infektioita hoidetaan sekä sairaalassa että yhteisössä yleisesti muilla kuin β-laktaamiantibiooteilla, kuten klindamysiinillä (linkosamiini) ja ko-trimoksatsolilla (tunnetaan myös yleisesti nimellä trimetopriimi / sulfametoksatsoli ). Resistenssi näitä antibiootteja kohtaan on johtanut myös uusien, laajakirjoisten anti-gram-positiivisten antibioottien, kuten linetsolidin , käyttöön, koska niitä on saatavana suun kautta otettavina lääkkeinä. MRSA: n aiheuttamien vakavien invasiivisten infektioiden ensilinjan hoito on tällä hetkellä glycopeptidiantibiootteja (vankomysiini ja teikoplaniini ). Näiden antibioottien kanssa ilmenee useita ongelmia, kuten tarve antaa laskimonsisäinen annos (oraalista valmistetta ei ole saatavilla), myrkyllisyys ja tarve seurata lääkkeiden pitoisuuksia säännöllisesti verikokeilla. Myös glykopeptidiantibiootit eivät tunkeudu kovin hyvin tartunnan saaneisiin kudoksiin (tämä koskee erityisesti aivojen ja aivokalvon infektioita ja endokardiittia ). Glycopeptidejä ei saa käyttää metisilliinille herkän S. aureuksen (MSSA) hoitoon , koska tulokset ovat huonompia.
Koska penisilliiniresistenssi on korkea ja koska MRSA voi kehittää vastustuskykyä vankomysiinille, Yhdysvaltain tautien torjunta- ja ehkäisykeskukset ovat julkaisseet ohjeet vankomysiinin asianmukaisesta käytöstä. Tilanteissa, joissa MRSA -infektioiden ilmaantuvuuden tiedetään olevan korkea, hoitava lääkäri voi päättää käyttää glykopeptidiantibioottia, kunnes tarttuvan organismin identiteetti on tiedossa. Sen jälkeen kun on varmistettu, että infektio johtuu metisilliinille herkästä S. aureus -kannasta , hoito voidaan vaihtaa tarvittaessa flukloksasilliiniksi tai jopa penisilliiniksi.
Vankomysiiniresistentti S. aureus (VRSA) on S. aureuksen kanta, josta on tullut resistentti glycopeptideille. Ensimmäinen vankomysiini-välituote S. aureus (VISA) -tapaus raportoitiin Japanissa vuonna 1996; mutta ensimmäinen tapaus S. aureuksesta, joka oli todella resistentti glycopeptidiantibiooteille, raportoitiin vasta vuonna 2002. Yhdysvalloissa oli raportoitu kolme VRSA -infektiotapausta vuodesta 2005. Ainakin osittain S. aureus -bakteerin mikrobilääkeresistenssi voidaan selittää sen kyky sopeutua. Useat kaksikomponenttiset signaalinsiirtoreitit auttavat S. aureusta ilmentämään geenejä, joita tarvitaan selviytymään antimikrobisen stressin alaisena.
Kuljetus
Noin 33% Yhdysvaltain väestöstä kantaa S. aureusta ja noin 2% kantaa MRSA: ta . Jopa terveydenhuollon tarjoajat voivat olla MRSA -kolonisaattoreita
S. aureuksen kuljettaminen on tärkeä sairaalassa hankitun infektion (kutsutaan myös sairaalaksi) ja yhteisössä hankitun MRSA: n lähde . Vaikka S. aureus -bakteeria voi esiintyä isännän iholla, suuri osa sen kuljetuksesta kulkee nenän kautta kulkevien eturaivojen läpi ja voi olla läsnä myös korvissa. Nenäkäytävien kyky kantaa S. aureusta johtuu yhdistelmästä heikentyneestä tai viallisesta isännän immuniteetista ja bakteerin kyvystä kiertää isännän luontaista immuniteettia. Nenän kuljetus liittyy myös staph -infektioiden esiintymiseen.
Tartuntatautikontrolli
S. aureus (mukaan lukien MRSA) leviää yleensä ihmisestä ihmiseen, vaikka äskettäin jotkut eläinlääkärit ovat havainneet, että infektio voi levitä lemmikkien välityksellä, ja ympäristön saastumisen uskotaan olevan suhteellisen vähemmän tärkeä. Painotetaan perus käsien pesu tekniikat ovat näin ollen tehokas estämään sen lähetyksen. Kertakäyttöisten esiliinojen ja käsineiden käyttö henkilöstön välillä vähentää ihokosketusta, mikä vähentää edelleen tartuntariskiä .
Äskettäin lukuisia S. aureus -tapauksia on raportoitu sairaaloissa ympäri Amerikkaa. Taudinaiheuttajan siirtymistä helpotetaan lääketieteellisissä olosuhteissa, joissa terveydenhuollon työntekijöiden hygienia on riittämätön. S. aureus on uskomattoman kestävä bakteeri, kuten osoitettiin tutkimuksessa, jossa se selviytyi polyesteristä vajaat kolme kuukautta; polyesteri on tärkein materiaali, jota käytetään sairaalan yksityisyysverhoissa.
Bakteerit kuljetetaan terveydenhuollon työntekijöiden käsiin, jotka voivat noutaa ne näennäisesti terveeltä potilaalta, jolla on hyvänlaatuinen tai kommensalinen S. aureus -kanta , ja siirtää sen sitten seuraavalle hoidettavalle potilaalle. Bakteerien pääsy verenkiertoon voi johtaa erilaisiin komplikaatioihin, mukaan lukien endokardiitti, aivokalvontulehdus ja, jos se on laajalle levinnyt, sepsis .
Etanoli on osoittautunut tehokkaaksi paikalliseksi desinfiointiaineeksi MRSA: ta vastaan. Kvaternaarista ammoniumia voidaan käyttää yhdessä etanolin kanssa desinfiointitoimenpiteen keston pidentämiseksi. Ehkäisyyn sairaalainfektioiden liittyy rutiinia ja terminaalin puhdistukseen . Palamaton alkoholihöyry CO: ssa
2 NAV-CO2- järjestelmillä on etu, koska ne eivät hyökkää lääketieteellisissä ympäristöissä käytettävien metallien tai muovien kimppuun eivätkä edistä antibakteerista vastustuskykyä.
Tärkeä ja aiemmin tunnistamaton keino yhteisöön liittyvä MRSA-kolonisaatio ja -siirto on seksuaalisen kontaktin aikana.
S. aureus tapetaan minuutissa 78 ° C: ssa ja kymmenessä minuutissa 64 ° C: ssa, mutta se kestää jäätymistä .
Tiettyjen S. aureus -kantojen on kuvattu kestävän kloorin desinfiointia
Mupirosiinivoiteen käyttö voi vähentää S. aureuksen nenän kuljetuksesta johtuvien infektioiden määrää . On vain vähän näyttöä siitä, että S. aureuksen nenän dekontaminaatio käyttämällä antibiootteja tai antiseptisiä aineita voi vähentää kirurgisten infektioiden määrää.
| Yleisin bakteeri kaikilla toimialoilla | |
|---|---|
| Ateria -ala | Vibrio parahaemolyticus , S. aureus , Bacillus cereus |
| Lääketieteellinen teollisuus | Escherichia coli , S. aureus , Pseudomonas aeruginosa |
Tutkimus
Vuodesta 2021 lähtien S. aureusta vastaan ei ole hyväksyttyä rokotetta . Varhaisia kliinisiä kokeita on tehty useille rokotekandidaateille, kuten Nabin StaphVax ja PentaStaph, Intercell's / Merck's V710, VRi's SA75 ja muut.
Vaikka jotkut näistä rokotekandidaateista ovat osoittaneet immuunivasteita, toiset pahentavat S. aureus -infektiota . Toistaiseksi mikään näistä ehdokkaista ei suojaa S. aureus -infektiota vastaan. Nabin StaphVaxin kehittäminen pysäytettiin vuonna 2005, kun vaiheen III tutkimukset epäonnistuivat. Intercellin ensimmäinen V710 -rokotevaihtoehto lopetettiin vaiheen II/III aikana sen jälkeen, kun potilailla, joilla kehittyi S. aureus -infektio, havaittiin korkeampaa kuolleisuutta ja sairastuvuutta .
Nabin tehostettu S. aureus -rokotteiden ehdokas PentaStaph myytiin vuonna 2011 GlaxoSmithKline Biologicals SA: lle. PentaStaphin nykyinen tila on epäselvä. WHO asiakirja osoittaa, että PentaStaph ole vaiheen III tutkimuksessa vaiheessa.
Vuonna 2010 GlaxoSmithKline aloitti vaiheen 1 sokkotutkimuksen GSK2392103A -rokotteensa arvioimiseksi. Vuodesta 2016 lähtien tätä rokotetta ei ole enää aktiivisesti kehitetty.
Yhdysvaltain elintarvike- ja lääkevirasto myönsi Pfizerin S. aureus -neli-antigeenirokotteen SA4Ag helmikuussa 2014. Pfizer on saanut nopean nimeämisen helmikuussa 2014. Vuonna 2015 Pfizer on aloittanut vaiheen 2b kokeilun SA4Ag-rokotteen suhteen. Helmikuussa 2017 julkaistut vaiheen 1 tulokset osoittivat SA4Ag: n erittäin vahvan ja turvallisen immunogeenisyyden. Rokotetta kokeiltiin kesäkuuhun 2019 asti, ja tulokset julkaistiin syyskuussa 2020, ja ne eivät osoittaneet leikkauksen jälkeisen verenkierron infektion merkittävää vähenemistä.
Vuonna 2015 Novartis Vaccines and Diagnostics, entinen Novartis- divisioona ja nyt osa GlaxoSmithKlinea, julkaisi lupaavia prekliinisiä tuloksia heidän nelikomponenttisesta Staphylococcus aureus -rokotteesta, 4C-staph.
Vuonna 2020 eteerisellä öljyllä, joka uutettiin hydrotislaamalla Myrciaria pilosa -lehdistä, havaittiin olevan potentiaalia mikrobilääkkeenä torjumaan moniresistenttien Staphylococcus aureus -kantojen aiheuttamaa infektiota.
Standardikannat
Tutkimuksessa ja laboratoriokokeissa käytetään useita S. aureus -kantoja (joita kutsutaan "tyyppiviljelmiksi").
| Nimi | NCTC | ATCC | Talletusvuosi | Kommentti |
|---|---|---|---|---|
| Oxford H. | 6571 | 9144 | 1943 | Vakiokanta, jota käytetään penisilliinin tehon testaamiseen ja jolla penisilliiniyksikkö määritettiin alun perin. |
| Rosenbach | 12973 | 29213 | 1884 | Vakiokanta EUCAST -mikrobilääkeresistenssitestaukseen. |
Viitteet
Lue lisää
- Loskill P, Pereira PM, Jung P, Bischoff M, Herrmann M, Pinho MG, Jacobs K (syyskuu 2014). "Peptidoglykaanin silloittumisen väheneminen vähentää Staphylococcus aureus -solun verhokäyrän jäykkyyttä" . Biofyysinen lehti . 107 (5): 1082–1089. Bibcode : 2014BpJ ... 107.1082L . doi : 10.1016/j.bpj.2014.07.029 . PMC 4156677 . PMID 25185544 .
- Benson MA, Ohneck EA, Ryan C, Alonzo F, Smith H, Narechania A, Kolokotronis SO, Satola SW, Uhlemann AC, Sebra R, Deikus G, Shopsin B, Planet PJ, Torres VJ (elokuu 2014). "Hypervirulenssin kehittyminen MRSA -kloonin avulla hankkimalla siirrettävä elementti" . Molekyylimikrobiologia . 93 (4): 664–81. doi : 10.1111/mmi.12682 . PMC 4127135 . PMID 24962815 .
Ulkoiset linkit
| Luokitus |
|---|
- StopMRSANow.org - Keskustele MRSA: n leviämisen estämisestä
- TheMRSA.com - Ymmärrä, mistä MRSA -infektiossa on kyse.
- " Staphylococcus aureus " . NCBI -taksonomiaselain . 1280.
- Packham C (16. maaliskuuta 2015). "Onnistunut in vivo -testi Staphylococcus aureus -rokotteen läpimurtosta" . Medical Press . Arkistoitu alkuperäisestä 19. syyskuuta 2012 . Haettu 18. maaliskuuta 2015 .
- Tyypin Staphylococcus aureus -kanta Bac Dive - Bakteerien monimuotoisuuden metatietokanta