Adenoon liittyvä virus - Adeno-associated virus
| Adenoon liittyvä virus | |
|---|---|
|
|
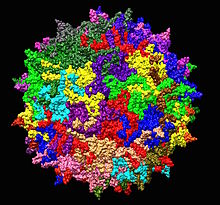
| Adenoon liittyvä viruksen serotyypin 2 rakenne 1LP3: sta . Yksi viisinkertainen akseli näkyy keskellä. | |
|
Tieteellinen luokittelu |
|
| (järjestämättä): | Virus |
| Valtakunta : | Monodnaviria |
| Kuningaskunta: | Shotokuvirae |
| Pylum: | Cossaviricota |
| Luokka: | Quintovirukset |
| Tilaus: | Piccovirales |
| Perhe: | Parvoviridae |
| Alaperhe: | Parvovirinae |
| Suku: | Dependoparvovirus |
| Viruksia ovat: | |
|
|
Adenoon liittyvät virukset ( AAV ) ovat pieniä viruksia, jotka tartuttavat ihmisiä ja joitakin muita kädellisiä . Ne kuuluvat sukuun Dependoparvovirus , joka puolestaan kuuluu Parvoviridae -heimoon . Ne ovat pieniä (20 nm ) replikaatiovikoja sisältäviä , vaipattomia viruksia ja niillä on lineaarinen yksijuosteinen DNA (ssDNA) -genomi, joka on noin 4,8 kilobaasia (kb).
AAV: n ei tällä hetkellä tiedetä aiheuttavan tautia . Virukset aiheuttavat erittäin lievän immuunivasteen . Useita lisäominaisuuksia tekevät AAV houkuttelevan ehdokkaan luoda virusvektoreita varten geeniterapiaan , ja luomaan isogeeni- ihmisten sairauksien malleissa . Geeniterapian vektoreita käyttäen AAV voi infektoida sekä jako ja lepotilassa olevat solut sinnikkäästi ja kromosomin tilassa ilman integroitumaan genomiin isäntäsolun, vaikka natiivi virus integrointi viruksen suorittaa geenien isännän genomiin tapahtuu. Integraatio voi olla tärkeä tietyille sovelluksille, mutta sillä voi olla myös ei -toivottuja seurauksia. Viimeaikaiset ihmisen kliiniset tutkimukset, joissa käytettiin AAV: tä geeniterapiassa verkkokalvossa, ovat osoittaneet lupauksen.
Historia
Adeno-associated virus (AAV), luultu epäpuhtautena adenovirus valmisteissa, oli ensimmäinen tunnistettu dependoparvovirus 1960 laboratorioissa Bob Atchison vieraissa Pittsburgh ja Wallace Rowe klo NIH . Ihmisillä tehdyt serologiset tutkimukset osoittivat myöhemmin, että vaikka AAV itse ei aiheuttanut tautia , vaikka se esiintyi auttajavirusten , kuten adenoviruksen tai herpesviruksen, tartuttamissa ihmisissä .
Käyttö geeniterapiassa
Edut ja haitat
Villityyppinen AAV on herättänyt huomattavaa kiinnostusta geeniterapian tutkijoilta useiden ominaisuuksien vuoksi. Tärkein näistä on viruksen ilmeinen patogeenisuuden puute. Se voi myös tartuttaa ei-jakautuvia soluja ja sillä on kyky integroitua stabiilisti isäntäsolun genomiin tietyssä paikassa (nimetty AAVS1: ksi) ihmisen kromosomissa 19 . Tämä ominaisuus tekee siitä hieman ennakoitavamman kuin retrovirukset , jotka uhkaavat satunnaisen lisäyksen ja mutageneesin, jota joskus seuraa syövän kehittyminen . AAV -genomi integroituu useimmiten mainittuun paikkaan, kun taas satunnaiset liittämiset genomiin tapahtuvat vähäisellä taajuudella. Kehittäminen AAV geenihoitovektoriksi, kuitenkin, on poistanut tämän integraatiokykyä poistamalla rep ja cap päässä DNA- vektorin. Haluttu geeni yhdessä promoottorin kanssa, joka edistää geenin transkriptiota, työnnetään käänteisten terminaalisten toistojen (ITR) väliin, mikä auttaa ketjutuksen muodostumisessa ytimessä sen jälkeen, kun isäntäsolun DNA-polymeraasikompleksit ovat muuttaneet yksijuosteisen vektori-DNA: n kaksijuosteiseksi DNA. AAV-pohjaiset geeniterapiavektorit muodostavat episomaalisia ketjuttajia isäntäsolun ytimessä. Ei-jakautuvissa soluissa nämä yhdistäjät pysyvät ehjinä isäntäsolun eliniän ajan. Jakautuvissa soluissa AAV DNA häviää solujakautumisen kautta, koska episomaalinen DNA ei replikoitu isäntäsolun DNA: n kanssa. AAV -DNA: n satunnainen integroituminen isäntägenomiin on havaittavissa, mutta tapahtuu hyvin alhaisella taajuudella. AAV: illä on myös hyvin alhainen immunogeenisyys , joka näennäisesti rajoittuu neutraloivien vasta -aineiden muodostamiseen , kun taas ne eivät aiheuta selkeästi määriteltyä sytotoksista vastetta . Tämä ominaisuus sekä kyky tartuttaa lepotilassa olevat solut esittelevät hallitsevuutensa adenoviruksiin ihmisen geeniterapian vektoreina .
Viruksen käytöllä on joitain haittoja. Vektorin kloonauskapasiteetti on suhteellisen rajallinen ja useimmat terapeuttiset geenit edellyttävät viruksen 4,8 kilobaasin perimän täydellistä korvaamista. Suuret geenit eivät siksi sovellu käytettäväksi tavallisessa AAV -vektorissa. Vaihtoehtoja tutkitaan parhaillaan rajoitetun koodauskapasiteetin voittamiseksi. Kahden genomin AAV-ITR: t voivat hehkuttaa muodostaen pään ja hännän välisen ketjutuksen, mikä lähes kaksinkertaistaa vektorin kapasiteetin. Jatkoskohtien lisääminen mahdollistaa ITR: ien poistamisen transkriptiosta.
AAV: n erityisten geeniterapiaetujen vuoksi tutkijat ovat luoneet muutetun version AAV: sta, jota kutsutaan itsekomplementtiseksi adeno-assosioituneeksi virukseksi (scAAV) . Kun AAV pakkaa yhden DNA -juosteen ja joutuu odottamaan toisen juosteensa syntetisointia, scAAV pakkaa kaksi lyhyempää juosetta, jotka täydentävät toisiaan. Välttämällä toisen juosteen synteesiä scAAV voi ilmentyä nopeammin, vaikka varoituksena scAAV voi koodata vain puolet AAV: n jo rajallisesta kapasiteetista. Viimeaikaiset raportit viittaavat siihen, että scAAV -vektorit ovat immunogeenisempiä kuin yksijuosteiset adenovirusvektorit, mikä saa aikaan sytotoksisten T -lymfosyyttien voimakkaamman aktivaation .
Villityypin tartunnan aiheuttaman humoraalisen immuniteetin uskotaan olevan yleistä. Tähän liittyvä neutraloiva aktiivisuus rajoittaa yleisimmin käytetyn serotyypin AAV2 hyödyllisyyttä tietyissä sovelluksissa. Näin ollen suurin osa käynnissä olevista kliinisistä tutkimuksista sisältää AAV2: n toimittamisen aivoihin, suhteellisen immunologisesti etuoikeutettu elin. Aivoissa AAV2 on voimakkaasti neuronispesifinen.
Kliiniset tutkimukset
Vuodesta 2019 lähtien AAV-vektoreita on käytetty yli 250 kliinisessä tutkimuksessa eri puolilla maailmaa, noin 8,3% viruksen sisältämistä geeniterapiatutkimuksista. Viime aikoina vaiheen 1 ja vaiheen 2 tutkimuksista on saatu lupaavia tuloksia useista sairauksista, mukaan lukien Leberin synnynnäinen amauroosi , hemofilia , kongestiivinen sydämen vajaatoiminta , selkärangan lihasten atrofia , lipoproteiinilipaasipuutos ja Parkinsonin tauti .
| Indikaatio | Gene | Antotapa | Vaihe | Aiheen numero | Tila |
| Kystinen fibroosi | CFTR | Keuhko, aerosolin kautta | Minä | 12 | Saattaa loppuun |
| CFTR | Keuhko, aerosolin kautta | II | 38 | Saattaa loppuun | |
| CFTR | Keuhko, aerosolin kautta | II | 100 | Saattaa loppuun | |
| Hemofilia B | KORJATA | Lihakseen | Minä | 9 | Saattaa loppuun |
| KORJATA | Maksan valtimo | Minä | 6 | Päättynyt | |
| Niveltulehdus | TNFR: Fc | Intraartikulaarinen | Minä | 1 | Jatkuva |
| Perinnöllinen emfyseema | AAT | Lihakseen | Minä | 12 | Jatkuva |
| Leberin synnynnäinen amauroosi | RPE65 | Subretinaali | I – II | Useita | Useita käynnissä olevia ja valmiita |
| Ikään liittyvä silmänpohjan rappeuma | sFlt-1 | Subretinaali | I – II | 24 | Jatkuva |
| Duchennen lihasdystrofia | SGCA | Lihakseen | Minä | 10 | Jatkuva |
| Parkinsonin tauti | GAD65 , GAD67 | Kallonsisäinen | Minä | 12 | Saattaa loppuun |
| Canavanin tauti | AAC | Kallonsisäinen | Minä | 21 | Jatkuva |
| Battenin tauti | CLN2 | Kallonsisäinen | Minä | 10 | Jatkuva |
| Alzheimerin tauti | NGF | Kallonsisäinen | Minä | 6 | Jatkuva |
| Selkärangan lihasten atrofia | SMN1 | Laskimonsisäinen ja intratekaalinen | I – III | 15 | Useita käynnissä olevia ja valmiita |
| Sydämen vajaatoiminta | SERCA2a | Sepelvaltimon sisäinen | IIb | 250 | Jatkuva |
Rakenne
Genomi, transkripti ja proteomi
AAV-genomi on rakennettu yksijuosteisesta deoksiribonukleiinihaposta (ss DNA ), joko positiivisella tai negatiivisella aistilla, joka on noin 4,7 kilobaasia pitkä. Genomi käsittää ITR: t DNA -juosteen molemmissa päissä ja kaksi avointa lukukehystä (ORF): rep ja cap . Ensimmäinen koostuu neljästä päällekkäisestä geenistä, jotka koodaavat AAV: n elinkaarelle tarvittavia Rep -proteiineja, ja jälkimmäinen sisältää päällekkäisiä kapsidiproteiinien nukleotidisekvenssejä : VP1, VP2 ja VP3, jotka vuorovaikutuksessa muodostavat kapsidin ikosaedrisen symmetrian kanssa.
ITR -sekvenssit
Invertoidun terminaalisen toiston (ITR) sekvenssit käsittävät 145 emästä kohden. Ne nimettiin niin niiden symmetrian vuoksi, mikä osoitettiin olevan tarpeen AAV -genomin tehokkaan lisääntymisen kannalta. Näiden sekvenssien ominaisuus, joka antaa heille tämän ominaisuuden, on niiden kyky muodostaa hiusneula , joka edistää niin sanottua itseimevää, joka mahdollistaa primaasista riippumattoman toisen DNA-juosteen synteesin. ITR: t osoitettiin myös tarpeellisiksi sekä AAV -DNA: n integroimiseksi isäntäsolun genomiin (19. kromosomi ihmisissä) että pelastamiseen siitä, sekä AAV -DNA : n tehokkaaseen kapselointiin yhdistettynä täysin kootun deoksiribonukleaasin muodostamiseen -kestävät AAV -hiukkaset.
Mitä tulee geeniterapiaan, ITR: t näyttävät olevan ainoat cis: ssä tarvittavat sekvenssit terapeuttisen geenin vieressä: rakenne- ( korkki ) ja pakkaus ( rep ) proteiineja voidaan toimittaa trans -trans . Tällä oletuksella luotiin monia menetelmiä reportteri- tai terapeuttisen geenin sisältävien rekombinanttisten AAV -vektorien tehokkaaseen tuottamiseen . Kuitenkin myös julkaistiin, että ITR: t eivät ole ainoita elementtejä, joita vaaditaan cis : ssä tehokkaaseen replikointiin ja kapselointiin. Muutamat tutkimusryhmät ovat tunnistaneet sekvenssin, joka on nimetty cis-toimivaksi Rep-riippuvaiseksi elementiksi (CARE) rep- geenin koodaavan sekvenssin sisällä . CARE: n osoitettiin lisäävän replikaatiota ja kapseloitumista, kun se on läsnä cis: ssä .
rep -geeni ja Rep -proteiinit
Genomin "vasemmalla puolella" on kaksi promoottoria, joita kutsutaan p5: ksi ja p19: ksi, joista voidaan valmistaa kaksi päällekkäistä , eripituista lähettimen ribonukleiinihappoa ( mRNA ). Jokainen näistä sisältää intronin, joka voidaan joko liittää tai ei. Näiden mahdollisuuksien perusteella voidaan syntetisoida neljä erilaista mRNA: ta ja siten neljä erilaista Rep -proteiinia, joiden sekvenssi on päällekkäin. Niiden nimet kuvaavat niiden kokoa kilodaltoneina (kDa): Rep78, Rep68, Rep52 ja Rep40. Rep78 ja 68 voivat sitoa spesifisesti ITR: n muodostaman hiusneulan itseimevässä toiminnassa ja katkaista tietyllä alueella, nimetyllä terminaalisen resoluutiokohdalla, hiusneulalla. Ne osoitettiin myös välttämättömiksi AAVS1-spesifisen AAV-genomin integroinnin kannalta. Kaikkien neljän Rep -proteiinin osoitettiin sitovan ATP: tä ja helikaasiaktiivisuutta . Osoitettiin myös, että ne säätelevät p40 -promoottorin transkriptiota (mainittu alla), mutta säätelevät sekä p5- että p19 -promoottoreita.
cap -geeni ja VP -proteiinit
Positiivisesti tunnistetun AAV-genomin oikea puoli koodaa kolmen kapsidiproteiinin, VP1, VP2 ja VP3, päällekkäisiä sekvenssejä, jotka alkavat yhdestä promoottorista, nimetty p40: ksi. Näiden proteiinien molekyylipainot ovat vastaavasti 87, 72 ja 62 kilodaltonia. AAV -kapsidi koostuu VP1-, VP2- ja VP3 -seoksesta, yhteensä 60 monomeeria, jotka on järjestetty ikosaedriseen symmetriaan suhteessa 1: 1: 10 ja joiden arvioitu koko on 3,9 MegaDaltonia. Kiderakenne on VP3-proteiini määritettiin Xie, Bue, et ai.
Cap -geeni tuottaa ylimääräinen, ei-rakenteellinen proteiini, jota kutsutaan Assembly-aktivoiva proteiini (AAP). Tämä proteiini on tuotettu ORF2: sta ja on välttämätön kapsidin kokoonpanoprosessissa. Tämän proteiinin tarkkaa toimintaa kokoonpanoprosessissa ja sen rakennetta ei ole tähän mennessä ratkaistu.
Kaikki kolme VP: tä käännetään yhdestä mRNA: sta. Tämän mRNA: n syntetisoinnin jälkeen se voidaan silmukoida kahdella eri tavalla: joko pidempi tai lyhyempi introni voidaan leikata pois, mikä johtaa kahden mRNA-poolin muodostamiseen: 2,3 kb: n ja 2,6 kb: n mRNA-pooliin. Yleensä, etenkin adenoviruksen läsnä ollessa , pidempi introni on edullinen, joten 2,3 kb pitkä mRNA edustaa niin sanottua "suurta silmukointia". Tässä muodossa ensimmäinen AUG -kodoni , josta VP1 -proteiinin synteesi alkaa, katkaistaan, mikä johtaa alentuneeseen VP1 -proteiinisynteesin kokonaistasoon. Ensimmäinen AUG -kodoni, joka pysyy pääliitoksessa, on VP3 -proteiinin aloituskodoni. Kuitenkin ylävirtaan kyseisestä kodonista samassa avoimessa lukukehyksessä on ACG -sekvenssi (joka koodaa treoniinia), jota ympäröi optimaalinen Kozak -konteksti . Tämä edistää VP2 -proteiinin, joka on itse asiassa VP3 -proteiini, jossa on lisää N -terminaalisia tähteitä, synteesin alhaista tasoa, kuten myös VP1.
Koska suurempi introni halutaan silmukoida, ja koska pääliitoksessa ACG -kodoni on paljon heikompi translaation aloitussignaali, suhde, jolla AAV -rakenneproteiinit syntetisoidaan in vivo, on noin 1: 1: 20, mikä on sama kuin kypsässä viruspartikkelissa. Ainutlaatuisella fragmentilla VP1 -proteiinin N -päässä osoitettiin olevan fosfolipaasi A2 (PLA2) -aktiivisuus, jota vaaditaan todennäköisesti AAV -hiukkasten vapauttamiseksi myöhäisistä endosomeista . Muralidhar et ai. kertoi, että VP2 ja VP3 ovat ratkaisevan tärkeitä virionin oikean kokoonpanon kannalta. Viime aikoina kuitenkin Warrington et ai. osoitti VP2: n olevan tarpeeton täydelliselle viruspartikkelin muodostumiselle ja tehokkaalle tarttuvuudelle, ja esitti myös, että VP2 voi sietää suuria insertioita N -päässään, kun taas VP1 ei kykene todennäköisesti PLA2 -domeenin läsnäolon vuoksi.
Luokittelu, serotyypit, reseptorit ja luontainen tropismi
Kansainvälinen virusten taksonomiakomitea tunnusti vuonna 2013 kaksi AAV-lajia : adenoihin liittyvä riippuvainen virus A (aiemmin AAV-1, -2, -3 ja -4) ja adenoihin liittyvä riippuvainen virus B (aiemmin AAV-5).
1990 -luvulle asti käytännössä kaikkea AAV -biologiaa tutkittiin käyttämällä AAV -serotyyppiä 2. Kuitenkin AAV on yleinen ihmisillä ja muilla kädellisillä, ja useita serotyyppejä on eristetty eri kudosnäytteistä. Serotyyppejä 2, 3, 5 ja 6 löydettiin ihmisen soluista, AAV -serotyyppejä 1, 4 ja 7–11 ei -inhimillisistä kädellisten näytteistä. Vuodesta 2006 lähtien on kuvattu 11 AAV -serotyyppiä , 11. vuonna 2004. AAV -kapsidiproteiinit sisältävät 12 hypervaihtuvaa pinta -aluetta, joista suurin osa vaihtelee kolminkertaisissa proksimaalisissa piikeissä, mutta parvoviruksen genomissa on yleensä erittäin konservoituneita replikaatiota ja rakennegeenejä eri serotyypeissä . Kaikki tunnetut serotyypit voivat tartuttaa soluja useista eri kudostyypeistä. Kudosspesifisyys määräytyy kapsidin serotyypin mukaan, ja AAV -vektorien pseudotyypitys niiden tropismialueen muuttamiseksi on todennäköisesti tärkeää niiden käytön kannalta hoidossa.
Serotyyppi 2
Serotyyppi 2 (AAV2) on toistaiseksi laajimmin tutkittu. AAV2 esittää luonnollista tropismia luustolihaksille , neuroneille , verisuonten sileille lihassoluille ja hepatosyyteille .
Kolme solun reseptorit on kuvattu AAV2: heparaanisulfaattiproteoglykaani (HSPG), joka on V- P 5 -integriiniin ja fibroblastikasvutekijä reseptori 1 (FGFR-1). Ensimmäinen toimii ensisijaisena reseptorina, kun taas kahdella jälkimmäisellä on yhteisreseptoriaktiivisuus ja ne mahdollistavat AAV: n pääsyn soluun reseptorivälitteisen endosytoosin avulla . Nämä tutkimustulokset ovat kiistäneet Qiu, Handa et ai. HSPG toimii ensisijaisena reseptorina, vaikka sen runsaus solunulkoisessa matriisissa voi poistaa AAV -hiukkasia ja heikentää infektion tehokkuutta.
Tutkimukset ovat osoittaneet, että viruksen serotyyppi 2 (AAV-2) ilmeisesti tappaa syöpäsoluja vahingoittamatta terveitä. "Tuloksemme viittaavat siihen, että adenoliitännäisvirus tyypin 2, joka tartuttaa suurin osa väestöstä, mutta ei ole tunnettuja haittavaikutuksia, tappaa useita erityyppisiä syöpäsoluja vielä ei ole vaikutusta terveiden solujen", sanoi Craig Meyers, professori immunologian ja mikrobiologian klo Penn State College of Medicine Pennsylvaniassa vuonna 2005. Tämä voisi johtaa uuteen syöpälääkkeen.
Muut serotyypit
Vaikka AAV2 on suosituin serotyyppi erilaisissa AAV-tutkimuksissa, on osoitettu, että muut serotyypit voivat olla tehokkaampia geenin toimitusvektoreina. Esimerkiksi AAV6 näyttää paljon paremmalta hengitysteiden epiteelisolujen tartuttamisessa, AAV7: llä on erittäin korkea hiiren luustolihasolujen transduktionopeus (samanlainen kuin AAV1 ja AAV5), AAV8 on loistava hepatosyyttien siirtämisessä ja AAV1 ja 5 osoittautuivat erittäin tehokkaiksi geeninsiirrossa verisuonten endoteelisoluihin. Aivoissa useimmat AAV -serotyypit osoittavat hermosolujen tropismia, kun taas AAV5 muuntaa myös astrosyyttejä. AAV6, AAV1: n ja AAV2: n hybridi, osoittaa myös heikompaa immunogeenisyyttä kuin AAV2.
Serotyypit voivat vaihdella suhteessa reseptoreihin, joihin ne ovat sitoutuneet. Esimerkiksi AAV4- ja AAV5-transduktio voidaan estää liukoisilla siaalihapoilla (eri muodoissa kullekin näistä serotyypeistä), ja AAV5: n osoitettiin saapuvan soluihin verihiutaleista johdetun kasvutekijäreseptorin kautta .
Synteettiset serotyypit
Uusia AAV -variantteja on pyritty suunnittelemaan ja parantamaan sekä kliinisiä että tutkimustarkoituksia varten. Tällaisia muutoksia ovat uudet tropismit kohdentamaan tiettyjä kudoksia ja modifioidut pintatähteet immuunijärjestelmän havaitsemisen välttämiseksi. Sen lisäksi , että tutkijat ovat valinneet tiettyjä rekombinantti -AAV -kantoja (rAAV) kohdistamaan tiettyjä soluja, tutkijat ovat myös tutkineet AAV -pseudotyyppiä, käytäntöä luoda tiettyjen AAV -kantojen hybridejä lähestyäkseen vielä hienostuneempaa kohdetta. Hybridi luodaan ottamalla kapsidi yhdestä kannasta ja genomi toisesta kannasta. Esimerkiksi tutkimus, johon osallistui AAV2/5, hybridi, jossa oli AAV2: n genomi ja AAV5: n kapsidi, pystyi saavuttamaan aivosoluissa enemmän tarkkuutta ja kantamaa kuin AAV2 pystyisi saavuttamaan hybridisoitumattoman. Tutkijat ovat jatkaneet pseudotyyppikokeilua luomalla kantoja hybridikapidideilla. AAV-DJ: llä on hybridikapsidi kahdeksasta eri AAV-kannasta; sellaisenaan se voi tartuttaa erilaisia soluja monilla kehon alueilla, mikä ominaisuus ei olisi yhdellä AAV -kannalla, jolla on rajoitettu tropismi. Muita pyrkimyksiä uusien AAV -varianttien suunnitteluun ja parantamiseen ovat olleet virusvarianttien esi -isien rekonstruointi uusien vektorien luomiseksi parannetuilla ominaisuuksilla kliinisiin sovelluksiin ja AAV -biologian tutkimukseen.
Immunologia
AAV on erityisen kiinnostava geeniterapeuteille, koska sen ilmeinen rajallinen kyky indusoida immuunivasteita ihmisillä on tekijä, jonka pitäisi vaikuttaa positiivisesti vektorinsiirtotehokkuuteen samalla kun vähennetään minkä tahansa immuunijärjestelmään liittyvän patologian riskiä .
AAV: lla ei katsota olevan mitään tunnettua roolia sairaudessa.
Kuitenkin isännän immuunijärjestelmän vaste ja immuunisietokyky vähentävät AAV-välitteisen geeniterapian tehokkuutta. Isännän immuunivasteen on osoitettu reagoivan AAV -vektoreihin, transdusoituihin soluihin ja transdusoituihin proteiineihin. Immuunivaste voidaan jakaa kahteen luokkaan: synnynnäinen ja adaptiivinen, joista jälkimmäinen on jaettu humoraaliseen ja soluvälitteiseen.
Synnynnäinen
Luontainen immuunivaste AAV-vektoreita on tunnettu siitä, eläinmalleissa. Laskimonsisäinen antaminen hiirille aiheuttaa ohimenevää tulehdusta edistävien sytokiinien tuotantoa ja jonkin verran neutrofiilien ja muiden leukosyyttien tunkeutumista maksaan, mikä näyttää sitovan suuren osan injektoiduista viruspartikkeleista. Sekä liukoisten tekijöiden tasot että solujen infiltraatio näyttävät palaavan lähtötasolle kuuden tunnin kuluessa. Sitä vastoin aggressiivisemmat virukset tuottavat synnynnäisiä vasteita, jotka kestävät 24 tuntia tai pidempään.
In vivo -tutkimukset osoittavat, että AAV-vektorit ovat vuorovaikutuksessa Toll-like reseptorin (TLR) 9- ja TLR2-MyD88-reittien kanssa synnyttääkseen luontaisen immuunivasteen stimuloimalla interferonien tuotantoa. On osoitettu, että hiiret, joista puuttuu TLR9, ovat alttiimpia AAV -hoidolle ja osoittavat korkeampaa siirtogeenin ilmentymistasoa
Humoraalinen
Aiemman luonnollisen infektion vuoksi monilla ihmisillä on jo olemassa neutraloivia vasta -aineita (NAb) AAV: ita vastaan, mikä voi merkittävästi haitata sen käyttöä geeniterapiassa. Vaikka AAV: t ovat hyvin vaihtelevia villityypin ja synteettisten varianttien välillä, vasta-aineiden tunnistuskohdat voidaan säilyttää evoluutiolla.
Viruksen tiedetään herättävän vahvan humoraalisen immuniteetin eläinmalleissa ja ihmispopulaatiossa, jossa jopa 80% yksilöistä uskotaan olevan seropositiivisia AAV2: lle. Vasta -aineiden tiedetään neutraloivan, ja geeniterapiasovelluksissa nämä vaikuttavat vektoritransduktiotehokkuuteen joidenkin antoreittien kautta. Pysyvien AAV-spesifisten vasta-ainetasojen lisäksi sekä eläimillä tehdyistä prime-boost-tutkimuksista että kliinisistä tutkimuksista käy ilmi, että myös B-solumuisti on vahva. Seropositiivisilla ihmisillä AAV2: ta kiertävät IgG -vasta -aineet näyttävät koostuvan pääasiassa IgG1- ja IgG2 -alaluokista, ja IgG3: ta tai IgG4: ää ei ole lainkaan.
Soluvälitteinen
Soluvälitteinen vaste virukselle ja vektorit on huonosti tunnettu, ja se on suurelta osin huomiotta kirjallisuudessa äskettäin kuin 2005. Kliiniset tutkimukset käyttäen AAV2-pohjainen vektori hoitoon hemofilia B näyttävät osoittavan, että kohdennettu tuhoaminen transdusoitujen solujen voi esiintyä. Yhdistettynä tietoihin, jotka osoittavat, että CD8+ T-solut voivat tunnistaa AAV-kapsidin elementtejä in vitro , näyttää siltä, että AAV-vektoreihin saattaa liittyä sytotoksinen T-lymfosyyttivaste. Sytotoksiset vasteet merkitsisivät CD4+ T -auttajasolujen osallistumista AAV -vasteeseen, ja in vitro -tutkimukset inhimillisistä tutkimuksista viittaavat siihen, että virus voi todellakin aiheuttaa tällaisia vasteita, mukaan lukien sekä Th1- että Th2 -muistivaste. AAV -kapsidiproteiini VP1: stä on tunnistettu useita ehdokas -T -soluja stimuloivia epitooppeja , jotka voivat olla houkuttelevia kohteita kapsidin modifioimiseksi, jos virusta aiotaan käyttää vektorina geeniterapiassa.
Infektio sykli
AAV -infektiosyklissä on useita vaiheita solun tartuttamisesta uusien tarttuvien hiukkasten tuottamiseen:
- kiinnittyminen solukalvoon
- reseptorivälitteinen endosytoosi
- endosomaalikauppa
- paeta myöhäisestä endosomista tai lysosomista
- siirtyminen ytimeen
- pinnoitus
- AAV-genomin kaksijuosteisen DNA: n replikatiivisen muodon muodostuminen
- ilmentymistä rep -geenien
- genomin replikaatio
- ilmentymisen cap -geenien, synteesi jälkeläisten ssDNA hiukkasia
- täydellisten virionien kokoaminen ja
- vapautuminen tartunnan saaneesta solusta.
Jotkut näistä vaiheista voivat näyttää erilaisilta eri tyyppisillä soluilla, mikä osaltaan vaikuttaa osaltaan AAV: n määriteltyyn ja melko rajalliseen alkuperäiseen tropismiin. Viruksen replikaatio voi myös vaihdella yhdessä solutyypissä riippuen solun nykyisestä solusyklin vaiheesta.
Adenoon liittyvän viruksen ominaispiirre on replikaation puute ja siten sen kyvyttömyys lisääntyä vahingoittumattomissa soluissa. Adenoon liittyvä virus leviää infektoimalla solun yhdessä auttajaviruksen kanssa. Ensimmäinen auttajavirus, jonka kuvattiin tarjoavan uusien AAV -hiukkasten onnistuneen tuottamisen, oli adenovirus , josta AAV -nimi on peräisin. Sitten osoitettiin, että AAV: n replikaatiota voivat helpottaa valitut proteiinit, jotka on johdettu adenoviruksen genomista, muut virukset, kuten HSV tai vaccinia, tai genotoksiset aineet, kuten UV -säteily tai hydroksiurea . Auttajaviruksen läsnäolosta tai puuttumisesta riippuen AAV: n elinkaari seuraa joko lyyttistä tai lysogeenistä reittiä. Jos auttaja -virus on olemassa, AAV: n geeniekspressio aktivoituu, jolloin virus voi replikoitua isäntäsolun polymeraasin avulla. Kun auttajavirus tappaa isäntäsolun, uudet AAV -virionit vapautuvat. Jos auttajavirusta ei ole läsnä, AAV: lla on lysogeeninen käyttäytyminen. Kun AAV tartuttaa solun yksin, sen geeniekspressio tukahdutetaan (AAV ei replikoi) ja sen genomi sisällytetään isäntägenomiin (ihmisen kromosomiin 19). Harvinaisissa tapauksissa hajoaminen voi tapahtua ilman auttajavirusta, mutta yleensä AAV ei voi replikoitua ja tappaa solua yksin.
Matsushita, Ellinger et ai. Löysivät minimaalisen joukon adenovirusgeenejä, joita tarvitaan tehokkaaseen jälkeläisten AAV -hiukkasten tuottamiseen . Tämä löytö mahdollisti uusia yhdistelmä-AAV: n tuotantomenetelmiä, jotka eivät vaadi AAV: ta tuottavien solujen adenovirusinfektiota. Jos auttajavirusta tai genotoksisia tekijöitä ei ole, AAV -DNA voi joko integroitua isäntägenomiin tai pysyä episomaalisessa muodossa. Ensimmäisessä tapauksessa integraatiota välittävät Rep78- ja Rep68 -proteiinit, ja se vaatii integroitavaa aluetta reunustavien ITR: ien läsnäoloa. Hiirillä AAV-genomin on havaittu pysyvän pitkään lepotilassa olevissa kudoksissa, kuten luustolihaksissa, episomaalisessa muodossa (pyöreä pää-häntä-konformaatio).
Katso myös
Viitteet
Ulkoiset linkit
- Kimball JW (17. toukokuuta 2015). "Geeniterapia II" . Kimballin biologiasivut . Arkistoitu alkuperäisestä 18. maaliskuuta 2005 . Haettu 13. toukokuuta 2005 .
- " Adenoon liittyvä virus " . NCBI -taksonomiaselain . 272636.