Hybridoomatekniikka - Hybridoma technology
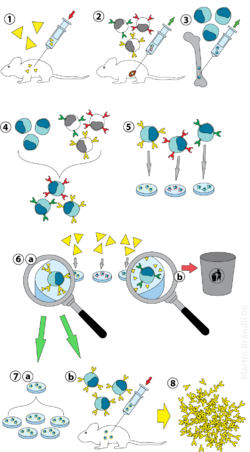
Hybridoomatekniikka on menetelmä tuottamaan suuri määrä identtisiä vasta-aineita (kutsutaan myös monoklonaalisiksi vasta-aineiksi ). Tämä prosessi alkaa injektoimalla hiirelle (tai muulle nisäkkäälle) antigeeni, joka aiheuttaa immuunivasteen. Valkosolujen tyyppi, B-solu , tuottaa vasta-aineita, jotka sitoutuvat injektoituun antigeeniin. Nämä vasta-ainetta tuottavat B-solut kerätään sitten hiiren ja, puolestaan, on fuusioitu kanssa kuolematon B-solujen syöpä soluja, myeloomasoluja , tuottamaan hybridi solulinja nimeltään hybridooma , jolla on sekä vasta-ainetta tuottava kyky B- myelooman pitkäikäisyys ja lisääntyvyys. Hybridoomia voidaan kasvattaa viljelmässä, kukin viljelmä alkaa yhdestä elinkelpoisesta hybridoomasolusta, tuottavat viljelmät, joista kukin koostuu geneettisesti identtisistä hybridoomista, jotka tuottavat yhden vasta-aineen viljelmää kohti (monoklonaalinen), eikä eri vasta-aineiden (polyklonaalisten) seoksista. Tässä prosessissa käytetty myeloomasolulinja valitaan sen kyvyn mukaan kasvaa kudosviljelmässä ja vasta-ainesynteesin puuttumisen vuoksi. Toisin kuin polyklonaaliset vasta-aineet , jotka ovat monien erilaisten vasta-ainemolekyylien seoksia, kunkin hybridoomalinjan tuottamat monoklonaaliset vasta-aineet ovat kaikki kemiallisesti identtisiä.
Monoklonaalisten vasta-aineiden tuotannon keksivät César Milstein ja Georges JF Köhler vuonna 1975. He jakoivat lääketieteen ja fysiologian Nobel-palkinnon vuonna 1984 Niels Kaj Jernen kanssa , joka teki muita panoksia immunologiaan. Termin hybridoma keksi Leonard Herzenberg sapattina César Milsteinin laboratoriossa vuosina 1976–1977.
Menetelmä
Laboratorioeläimet ( nisäkkäät , esim. Hiiret) altistetaan ensin antigeenille, jota vastaan vasta-aine on tarkoitus tuottaa. Yleensä tämä tapahtuu sarjaan kyseistä antigeeniä useiden viikkojen aikana. Näitä injektioita seuraa tyypillisesti in vivo elektroporaatio , joka parantaa merkittävästi immuunivastetta. Kun pernasolut on eristetty nisäkkään pernasta , B-solut fuusioidaan kuolemattomien myeloomasolujen kanssa. B-solujen fuusio myeloomasoluihin voidaan tehdä käyttämällä sähköfuusiota. Sähköfuusio saa B-solut ja myeloomasolut kohdistumaan ja sulautumaan sähkökentän avulla. Vaihtoehtoisesti B-solut ja myeloomat voidaan saada fuusioitumaan kemiallisilla menetelmillä, useimmiten käyttämällä polyetyleeniglykolia . Myeloomasolut valitaan etukäteen sen varmistamiseksi, että ne eivät eritä itse vasta-ainetta ja että niiltä puuttuu hypoksantiini-guaniinifosforibosyylitransferaasigeeni (HGPRT), mikä tekee niistä herkkiä HAT-väliaineelle (katso alla).
Fuusioituneita soluja inkuboidaan HAT-väliaineessa ( hypoksantiini - aminopteriini - tymidiiniväliaine ) noin 10 - 14 päivän ajan. Aminopteriini estää reitin, joka mahdollistaa nukleotidisynteesin. Siksi fuusioimattomat myeloomasolut kuolevat, koska ne eivät voi tuottaa nukleotideja de novo- tai pelastusreiteillä, koska niiltä puuttuu HGPRT. Fuusioimattomien myeloomasolujen poistaminen on välttämätöntä, koska niillä on potentiaalia kasvattaa muita soluja, erityisesti heikosti vakiintuneita hybridoomia. Fuusioimattomat B-solut kuolevat, koska niiden elinikä on lyhyt. Tällä tavoin vain B-solu-myelooman hybridit selviävät, koska B-soluista tuleva HGPRT-geeni on toiminnallinen. Nämä solut tuottavat vasta-aineita (B-solujen ominaisuus) ja ovat kuolemattomia (myeloomasolujen ominaisuus). Inkuboitu väliaine laimennetaan sitten monikuoppalevyille siinä määrin, että jokainen kuoppa sisältää vain yhden solun. Koska kuopan vasta-aineita tuottaa sama B-solu, ne kohdistuvat samaan epitooppiin ja ovat siten monoklonaalisia vasta-aineita.
Seuraava vaihe on nopea primaariseulontaprosessi, joka tunnistaa ja valitsee vain ne hybridoomat, jotka tuottavat sopivan spesifisen vasta-aineita. Ensimmäistä käytettyä seulontatekniikkaa kutsutaan ELISA: ksi . Sitten inkuboidaan hybridoomaviljelysupernatanttia, sekundäärisellä entsyymillä leimattua konjugaattia ja kromogeenista substraattia, ja värillisen tuotteen muodostuminen osoittaa positiivisen hybridooman. Vaihtoehtoisesti voidaan käyttää myös immunosytokemiallista, Western blot- ja immunosaostus-massaspektrometrista seulontaa. Toisin kuin Western blot -analyysit, immunosaostus-massaspektrometria helpottaa antigeeniproteiinien natiiviin (denaturoimattomiin) muotoihin sitoutuvien kloonien seulontaa ja järjestystä.
B-solu, joka tuottaa halutut vasta-aineet, voidaan kloonata tuottamaan monia identtisiä tytärklooneja. Interleukiini-6: ta (kuten briklonia ) sisältävät lisäväliaineet ovat välttämättömiä tässä vaiheessa. Kun hybridoomapaikka on muodostettu, se kasvaa jatkuvasti elatusaineessa, kuten RPMI-1640 (antibiooteilla ja naudan sikiön seerumilla) ja tuottaa vasta-aineita.
Monikuoppalevyjä käytetään aluksi hybridoomien kasvattamiseen ja valinnan jälkeen ne vaihdetaan suurempiin kudosviljelypulloihin. Tämä ylläpitää hybridoomien hyvinvointia ja tarjoaa riittävästi soluja kylmäsäilytykseen ja supernatantin myöhempiin tutkimuksiin. Viljelysupernatantti voi tuottaa 1 - 60 μg / ml monoklonaalista vasta-ainetta, jota pidetään -20 ° C: ssa tai alemmassa lämpötilassa, kunnes sitä tarvitaan.
Käyttämällä viljelysupernatanttia tai puhdistettua immunoglobuliinivalmistetta, potentiaalisen monoklonaalisen vasta-ainetta tuottavan hybridooman lisäanalyysi voidaan tehdä reaktiivisuuden, spesifisyyden ja ristireaktiivisuuden suhteen.
Sovellukset
Monoklonaalisten vasta-aineiden käyttö on lukuisaa ja sisältää sairauksien ehkäisyn, diagnosoinnin ja hoidon. Esimerkiksi monoklonaaliset vasta-aineet voivat erottaa B-solujen ja T-solujen alaryhmät , mikä on hyödyllistä erilaisten leukemioiden tunnistamisessa . Lisäksi monoklonaalisia vasta-aineita on käytetty määrittämään solun pinnan markkereita on valkosolujen ja muiden solutyyppien. Tämä johti markkerien erilaistumissarjan klusteriin . Näihin viitataan usein CD-markkereina, ja ne määrittelevät useita satoja solujen erilaisia solun pintakomponentteja, joista kukin määritetään sitoutumalla tiettyyn monoklonaaliseen vasta-aineeseen. Tällaiset vasta-aineet ovat erittäin käyttökelpoisia fluoresenssiaktivoitujen solujen lajittelussa , tietyntyyppisten solujen spesifisessä eristämisessä.
Diagnostisessa histopatologiassa
Monoklonaalisten vasta-aineiden avulla kudokset ja elimet voidaan luokitella niiden tiettyjen määriteltyjen markkereiden ilmentymisen perusteella, jotka heijastavat kudoksen tai solun syntyä. Eturauhasspesifinen antigeeni , istukan alkalinen fosfataasi , ihmisen koriongonadotropiini , a-fetoproteiini ja muut ovat elimistöön liittyviä antigeenejä, ja monoklonaalisten vasta-aineiden tuottaminen näitä antigeenejä vastaan auttaa määrittämään primaarikasvaimen luonteen.
Monoklonaaliset vasta-aineet ovat erityisen käyttökelpoisia morfologisesti samanlaisten vaurioiden, kuten pleura- ja peritoneaalisen mesoteliooman , adenokarsinooman , erottamisessa ja erilaistumattomien metastaasien elin- tai kudosperäisyyden määrittämisessä . Valitut monoklonaaliset vasta-aineet auttavat havaitsemaan okkultistiset metastaasit ( syöpä, jonka ensisijainen alkuperä on tuntematon ) luuytimen, muiden kudosaspiraattien, imusolmukkeiden ja muiden kudosten immunosytologisella analyysillä, ja niiden herkkyys voi olla suurempi kuin normaalissa histopatologisessa värjäyksessä .
Eräässä tutkimuksessa suoritettiin herkkä immunohistokemiallinen määritys 20 paikallista eturauhassyöpää sairastavan potilaan luuytimen aspiraateille. Määrityksessä käytettiin kolmea monoklonaalista vasta-ainetta (T16, C26 ja AE-1), jotka kykenevät tunnistamaan epiteelisolujen ilmentämät membraani- ja sytoskelettiantigeenit kasvainsolujen havaitsemiseksi. Luuytimen aspiraatit 22%: lla potilaista, joilla on paikallinen eturauhassyöpä (vaihe B, 0/5; vaihe C, 2/4) ja 36%: lla potilaista, joilla on etäpesäkkeinen eturauhassyöpä (vaihe D1, 0/7 potilasta; vaihe D2, 4 / 4 potilasta) luuytimessä oli antigeenipositiivisia soluja. Päätettiin, että luuytimen aspiraattien immunohistokemiallinen värjäys on erittäin hyödyllistä havaita piilevän luuytimen metastaasit potilailla, joilla on ilmeisesti paikallinen eturauhassyöpä.
Vaikka immunosytokemia, joka käyttää tuumoriin liittyviä monoklonaalisia vasta-aineita, on johtanut parempaan kykyyn havaita piilevät rintasyöpäsolut luuytimen aspiraateissa ja ääreisveressä, tämän menetelmän edelleen kehittäminen on välttämätöntä, ennen kuin sitä voidaan käyttää rutiininomaisesti. Yksi immunosytokemian merkittävä haittapuoli on, että käytetään vain tuumoriin liittyviä eikä tuumorispesifisiä monoklonaalisia vasta-aineita, ja seurauksena voi olla jonkinlainen ristireaktio normaalien solujen kanssa.
Rintasyövän vaiheittaisen tehokkuuden arvioimiseksi ja puhdistusohjelmien tehokkuuden arvioimiseksi ennen autologista kantasoluinfuusiota on tärkeää havaita jopa pienet määrät rintasyöpäsoluja. Immunohistokemialliset menetelmät ovat ihanteellisia tähän tarkoitukseen, koska ne ovat yksinkertaisia, herkkiä ja melko spesifisiä. Franklin et ai. suoritti herkän immunosytokemiallisen määrityksen käyttämällä neljän monoklonaalisen vasta-aineen (260F9, 520C9, 317G5 ja BrE-3) yhdistelmää tuumorisolupinnan glykoproteiineja vastaan rintasyöpäsolujen tunnistamiseksi luuytimessä ja perifeerisessä veressä. He päättelivät tuloksista, että luuytimen ja perifeerisen veren immunosytokemiallinen värjäys on herkkä ja yksinkertainen tapa havaita ja kvantifioida rintasyöpäsolut.
Yksi tärkeimmistä syistä metastaattiseen uusiutumiseen potilailla, joilla on kiinteitä kasvaimia, on pahanlaatuisten solujen varhainen leviäminen. Sytokeratiinien suhteen spesifisten monoklonaalisten vasta-aineiden (mAb) käyttö voi tunnistaa levinneet yksittäiset epiteelisyöpäsolut luuytimessä.
Yksi tutkimus kertoo kehittäneensä immunosytokemiallisen menetelmän sytokeratiinikomponentin nro. 18 (CK18) ja eturauhasspesifinen antigeeni (PSA). Tämä auttaisi levittämään yksittäisiä epiteelisyöpäsoluja edelleen eturauhassyöpää sairastavilla potilailla. Hyvänlaatuista eturauhasen hypertrofiaa sairastavien potilaiden kahdentoista kontrolliaspiraatin värjäys oli negatiivinen, mikä tukee edelleen CK18: n spesifisyyttä epiteelisyöpäsolujen havaitsemisessa luuytimessä.
Useimmissa tapauksissa pahanlaatuinen sairaus, jota komplisoi efuusio, neoplastiset solut voidaan helposti tunnistaa. Joissakin tapauksissa pahanlaatuisia soluja ei kuitenkaan ole niin helposti havaittavissa tai niiden läsnäolo on liian epäilyttävää kutsua sitä positiiviseksi raportiksi. Immunosytokemiallisten tekniikoiden käyttö lisää diagnostista tarkkuutta näissä tapauksissa.
Ghosh, Mason ja Spriggs analysoivat 53 näytettä pleura- tai vatsakalvonesteestä 41 potilaalta, joilla oli pahanlaatuinen sairaus. Tavanomainen sytologinen tutkimus ei ollut paljastanut yhtään neoplastista solua. Kolme monoklonaalista vasta-ainetta (anti-CEA, Ca1 ja HMFG-2) käytettiin pahanlaatuisten solujen etsimiseen. Immunosytokemiallinen leimaus suoritettiin tahrattomille tahroille, joita oli varastoitu -20 ° C: ssa 18 kuukauteen. Kaksitoista niistä 41 tapauksesta, joissa immunosytokemiallinen värjäys tehtiin, paljasti pahanlaatuiset solut. Tulos edusti diagnostisen tarkkuuden kasvua noin 20%. Tutkimuksessa pääteltiin, että potilailla, joilla epäillään pahanlaatuista tautia, immunosytokemiallista merkintää tulisi käyttää rutiininomaisesti sytologisesti negatiivisten näytteiden tutkimuksessa ja sillä on merkittäviä vaikutuksia potilaan hoitoon.
Toinen immunosytokemiallisen värjäyksen sovellus on kahden antigeenin havaitseminen samassa tahrassa. Kaksoisvärjäys kevytketjun vasta-aineilla sekä T- ja B-solumarkkereilla voi osoittaa lymfooman neoplastisen alkuperän.
Eräässä tutkimuksessa on raportoitu hybridoomasolulinjan (klooni 1E10) eristäminen, joka tuottaa monoklonaalisen vasta-aineen (IgM, k-isotyyppi). Tämä monoklonaalinen vasta-aine osoittaa spesifisen immunosytokemiallisen nukleolien värjäytymisen.
Kudokset ja kasvaimet voidaan luokitella tiettyjen markkereiden ilmentymisen perusteella monoklonaalisten vasta-aineiden avulla. Ne auttavat erottamaan morfologisesti samanlaiset vauriot ja määrittämään erilaistumattomien metastaasien elin- tai kudos alkuperän. Luuytimen, kudosaspiraalien, imusolmukkeiden jne. Immunosytologinen analyysi valikoiduilla monoklonaalisilla vasta-aineilla auttaa havaitsemaan okkulttimetastaaseja. Monoklonaaliset vasta-aineet lisäävät herkkyyttä havaita jopa pieniä määriä invasiivisia tai metastaattisia soluja. Sytokeratiinille spesifiset monoklonaaliset vasta-aineet (mAb) voivat havaita levinneet yksittäiset epiteelisyöpäsolut luuytimessä.
Viitteet
Ulkoiset linkit
- Hybridoomat Yhdysvaltain kansallisen lääketieteellisen kirjaston lääketieteellisten aiheiden otsikoissa (MeSH)
- "Hybridoomatekniikka" . Cancer-sarjan ymmärtäminen: immuunijärjestelmä . Kansallinen syöpäinstituutti . Arkistoitu alkuperäisestä 5. lokakuuta 2014.
- "Hybridoomasoluviljelmä" .