Bcr-Abl-tyrosiinikinaasin estäjä - Bcr-Abl tyrosine-kinase inhibitor
Bcr-Abl- tyrosiinikinaasin estäjät ( TKI ) ovat ensisijainen hoito useimmille potilaille, joilla on krooninen myelooinen leukemia (CML). Yli 90% CML-tapauksista johtuu kromosomaalisista poikkeavuuksista, jotka johtavat ns. Philadelphia-kromosomin muodostumiseen . Tämän poikkeavuuden havaitsi Peter Nowell vuonna 1960, ja se on seurausta fuusion Abelsonin ( Abl ) tyrosiinikinaasigeenin kromosomissa 9 ja murtumapiste-klusterin ( Bcr ) geenin välillä kromosomissa 22 , mikä johtaa kimeeriseen onkogeeniin ( Bcr-Abl ) ja konstitutiivisesti aktiivisen Bcr-Abl-tyrosiinikinaasin, joka on osallisena CML : n patogeneesissä . Yhdisteet on kehitetty estämään selektiivisesti tyrosiinikinaasia.
Ennen vuoden 2001 Yhdysvaltain elintarvike- ja lääkeviraston (FDA) imatinibin hyväksyntää ei ollut saatavilla lääkkeitä CML: n luonnollisen etenemisen muuttamiseksi. Vain sytotoksisia lääkkeitä, kuten busulfaania , hydroksiureaa tai interferoni- alfaa (rIFN-a), käytettiin. Vaikka Time- aikakauslehti nimitti ensimmäisen Bcr-Abl TK -inhibiittorin "maagiseksi luotiksi" syövän parantamiseksi , Bcr-Abl TKI: n toinen sukupolvi kehitettiin myöhemmin torjumaan syntynyttä alkuperäistä vastustusta .
Uusia vastus voi syntyä esimerkiksi: aminohapot, joiden mutaatiot sisällä Abl kinaasi domeeni , yli-ilmentyminen Bcr-Abl, lisääntynyt tuotanto transmembraanisen plasman proteiineihin , tai konstitutiivisen aktivaation alavirran signalointia molekyylien, kuten Src-perheen kinaasien .
Historia
CML: llä on hyvin määritelty molekyylikohde ja siihen kohdennetut suhteellisen selektiiviset hoidot, mikä ei päde nykyään useimpiin syöpiin ja kemoterapioihin . Bcr-Abl: tä pidettiin erittäin houkuttelevana lääkeaineen interventiokohteena, koska Bcr-Abl- fuusiogeeni koodaa konstitutiivisesti aktivoitunutta kinaasia. Lääkeaineiden löytämistä, joka kohdisti nimenomaan yksittäisen kinaasin ATP-sitoutumiskohdan, pidettiin melko haastavana tehtävänä, koska ihmisen genomissa tunnettiin satoja proteiinikinaaseja . TKI: n läsnä ollessa ATP: n sitoutuminen estetään, fosforylaatio estetään ja Bcr-Abl: tä ilmentävillä soluilla on joko selektiivinen kasvuhaitta tai ne läpikäyvät apoptoottisen solukuoleman.
Imatinibin lisääntyvän vastustuskyvyn ja suvaitsemattomuuden takia pyrittiin kehittämään uusia lääkkeitä, jotka voisivat estää Bcr-Abl-tyrosiinikinaasia. Tämä johti toisen sukupolven huumeiden löytämiseen. Vaikka imatinibin kehittämiseen käytettiin lääkeseulontaa, toisen sukupolven TKI: itä kehitettiin järkevällä lääkesuunnittelulla Bcr-Abl-tyrosiinikinaasin rakennebiologian lisääntyneen tiedon ansiosta .
Ensimmäinen sukupolvi
Imatinibi (STI571)
Imatinibi (Gleevec) löydettiin vuonna 1992, ja sitä pidetään ensimmäisen sukupolven lääkkeenä, koska se on ensimmäinen Bcr-Abl-tyrosiinikinaasin estäjä, jota käytetään CML: n hoidossa.
Kehitys
Imatinibin kehityksessä Bcr-Abl-tyrosiinikinaasin rakenteella oli rajallinen rooli, koska sitä ei tunnettu. High-throughput seulonta kemiallisten kirjastojen Novartis suoritettiin tunnistaa alkaen molekyyli, jota kutsuttiin pyrimidiini A. Tämä yhdiste toimi lyijy-yhdistettä ja sitten se testattiin ja modifioitu kehittämään imatinibi. Kun imidatsoliryhmä korvattiin bentsamidoryhmällä, yhdisteen spesifisyys kasvoi samalla kun sen aktiivisuus kinaasin estäjänä pysyi samana. Myöhemmin orto- metyylisubstituentin lisääminen pyrimidinyyliaminoryhmään lisäsi tehoa .
Sitova
Sittemmin kristallografinen tutkimukset ovat paljastaneet, että imatinibi sitoutuu kinaasi verkkotunnuksen ABL vain, kun toimialueen hyväksyy inaktiivisia tai "suljettu" konformaatiossa. Täällä glysiinirikas, P: tä sitova fosfaattisilmukka (P-silmukka) taittuu ATP- sitoutumiskohdan yli ja aktivointisilmukka hyväksyy konformaation, jossa se sulkee substraatin sitoutumiskohdan ja häiritsee ATP-fosfaatin sitoutumiskohdan estääkseen entsyymin katalyyttinen aktiivisuus. Asp Phe Gly (DFG) -triadin siirtyminen aktivointisilmukan N-terminaalipäässä johtaa altistumiseen sitoutumistaskulle, jota estäjät voivat hyödyntää. Tätä konformaatiota kutsutaan DFGoutiksi .
Imatinibi sitoutuu Abl-domeeniin kuuden vetysidosvuorovaikutuksen kautta . Tämä stabiloi imatinibi Bcr-Abl-kompleksin ja estää ATP: tä pääsemästä sitoutumiskohtaansa. Vetysidokset liity pyridiini -N ja selkäranka -NH ja Met -318, amino- pyrimidiini ja sivuketjun hydroksyyliryhmä on Thr -315, amidi-NH ja sivuketjun karboksylaatti on Glu -286, karbonyylin ja selkäranka-NH Asp -381, protonoidut metyyli piperatsiini kanssa selkäranka-karbonyyli-atomia Ile -360 ja Hänen -361. Lisäksi useat van der Waalsin vuorovaikutukset edistävät sitoutumista. Hydrofobinen tasku on muodostettu aminohappo- tähteiden Ile-293, Leu -298, Leu-354 ja Val -379 ympärillä fenyylirenkaan vieressä piperatsinyyli- metyyli ryhmä imatinibin. Havaitsemishetkellä, rakenteellisen tiedon puuttuessa, imatinibin vaikuttavalle selektiivisyydelle ei löytynyt selkeää selitystä.
Vaikka ensimmäisen sukupolven hoito saavutti erittäin korkean vasteprosentin ja matalan uusiutumisnopeuden KML-potilailla, joillakin potilailla on resistenssiä tai sietämättömyyttä imatinibille.
Huumeiden vastustuskyky
Lääkeresistenssi on tärkein ajuri Bcr-Abl TKI: n jatkuvassa tutkimuksessa ja kehittämisessä. Pian imatinibin käyttöönoton jälkeen tutkijat alkoivat kuvata useita in vitro -johdettuja solulinjoja, jotka olivat resistenttejä lääkkeelle. Tätä seurasi nopeasti potilaiden imatinibiresistenttien solujen kliininen kuvaus, joka on johtanut pyrkimyksiin ymmärtää paremmin näiden havaintojen taustalla olevaa biologiaa. Imatinibin terapeuttisen vasteen arvioinnit CML-potilailla perustuvat hematologisten , sytogeenisten ja molekyylisten välitavoitteiden saavuttamiseen. Potilaita, jotka eivät saavuta määriteltyjä vasteita ennalta määritetyissä aikajärjestyksissä, kuvataan ensisijaisesti vastustuskykyisiksi hoidolle, ja potilaita, jotka menettävät aiemmin saadut virstanpylväät taudin regressiossa, kutsutaan toissijaisesti vastustuskykyisiksi. Ennen johtopäätöksen tekemistä on tärkeää ottaa huomioon, että retrospektiiviset tiedot ovat osoittaneet, että imatinibi ei täytä vaatimuksia CML-potilailla, mikä voi johtaa ei-toivottuihin kliinisiin tuloksiin.
Yleensä imatinibiresistenssi voidaan jakaa Bcr-Abl-riippuvaisiin ja itsenäisiin mekanismeihin. Bcr-Abl-riippuvaiset mekanismit sisältävät Bcr-Abl-geenin yli-ilmentymisen tai monistamisen ja pistemutaatiot Bcr-Abl-kinaasidomeenissa, jotka häiritsevät imatinibin sitoutumista. Bcr-Abl: stä riippumattomat mekanismit sisältävät tekijöitä, jotka vaikuttavat imatinibin pitoisuuteen solussa, esimerkiksi muuttamalla lääkeaineen sisäänvirtausta ja ulosvirtausta sekä aktivoimalla Bcr-Abl: stä riippumattomia reittejä, kuten Src-kinaasiperheen jäseniä. Imatinibiresistenssiä voidaan tuottaa myös muilla mekanismeilla, joita ei mainita tässä, koska näiden mekanismien merkitys on edelleen kysymys kliinisten tietojen puuttuessa.
Bcr-Abl-riippuvaiset resistenssimekanismit
Bcr-Abl-kopiointi
Ensimmäiset raportit resistenssistä imatinibille kuvaavat onkogeenin monistumisen kehittymistä . Toisin sanoen patogeenistä Bcr-Abl-tyrosiinikinaasia koodaava geeni toistetaan DNA-sekvenssissä , mikä johtaa patogeenin korkeampaan ilmentymiseen. Imatinibiannoksen nostaminen voi ylittää tämäntyyppisen resistenssin, jos vakavia tai sietämättömiä haittavaikutuksia ei synny.
Bcr-Abl-mutaatio
Pistemutaatiot voivat aiheuttaa aminohapposubstituutioita Bcr-Abl-proteiinin kinaasidomeenissa ja häiritä imatinibin sitoutumiskohtaa tyrosiinikinaasissa, mikä johtaa herkkyyden menetykseen lääkkeelle. Nämä mutaatiot vaikuttavat normaalisti Bcr-Abl-proteiinin rakenteeseen, mikä johtaa joko lääkkeen ja Bcr-Abl-proteiinin kriittisten kontaktipisteiden keskeytymiseen tai konformaation muutoksen indusoitumiseen, mikä johtaa proteiiniin, johon imatinibi ei pysty sitoutumaan.
Mutaatioanalyysi taajuudet näkyvät kasvavan taudin, CML , etenee kroonisen vaiheen että blastikriisivaihetta . Tärkeimmät mutaatiot ovat P-silmukan mutaatiot ja T315I-mutaatio. Mutaatioita kinaasin muissa kohdissa on myös raportoitu, esimerkiksi C- heliksissä , SH2-domeenissa , substraatin sitoutumiskohdassa, aktivointisilmukassa ja C-terminaalisessa lohkossa. Joillakin näistä mutaatioista on kliininen merkitys, mutta mikään ei yhtä paljon kuin P-silmukan ja T315I-mutaatiot.
T315I-mutaatio
T315I on ainutlaatuinen mutaatio, koska se on vastustuskykyinen kaikille hyväksytyille Bcr-Abl-estäjille ennen ponatinibia . Sen aiheuttaa yksittäisen sytosiinin ja tymiinin (C -> T) emäsparin substituutio Abl-geenin ( Abl-proteiinin kodoni '315') sekvenssin kohdassa 944, jolloin aminohappo (T) hreoniini korvataan (I): llä. ainoasiini tässä tilassa - siis 'T315I'. Tämä substituutio eliminoi kriittisen happimolekyylin, jota tarvitaan vety sitoutumiseen imatinibin ja Abl-kinaasin välillä, ja luo myös steerisen esteen useimpien TKI: iden sitoutumiselle. Kun se löydettiin, arvioitiin, että jokainen kuudesta edenneen vaiheen CML-potilaasta, joilla oli imatinibiresistenssi, kantoivat tämän mutaation. T315I tuottaa minkä tahansa mutaation suurimman resistenssin sekä imatinibia että toisen sukupolven TKI: itä kohtaan. Ponatinib (Iclusig) mukaan Ariad hyväksyttiin vuonna 2013 käytettäväksi toissijaisena KML hoito, ja se on ainoa lisensoitu TKI joka sitoutuu T315I mutatoidun kinaasin onnistuneesti.
P-silmukan mutaatiot
Bcr-Abl: n rakenne sisältää kaksi joustavaa silmukkaa, ATP: tä sitovan P-silmukan ja aktivointisilmukan. Näillä silmukoilla on erityiset järjestelyt Bcr-Abl: n inaktiivisessa konformaatiossa, joka stabiloi peruskonformaation. Näiden silmukoiden mutaatiot destabiloivat silmukoiden järjestelyn siten, että kinaasidomeeni ei voi olettaa imatinibin sitoutumiseen tarvittavaa inaktiivista konformaatiota. P-silmukan alueen mutaatiot ovat yleisimpiä, ja niiden osuus mutaatioista on 36-48%. On kliinistä tietoa, joka osoittaa, että P-silmukan Bcr-Abl-mutaatiot ovat 70-100 kertaa vähemmän herkkiä imatinibille verrattuna natiiviin Bcr-Abl: ään.
Bcr-Abl Riippumattomat resistenssimekanismit
Lisämekanismeja on oletettu kuvaamaan eri mallijärjestelmissä havaittua resistenssiä, vaikka yksikään niistä ei ole selvästi tunnistettu ainoaksi kliinisen resistenssin lähteeksi.
P-glykoproteiinien aiheuttama lääkevuoto
Jotkut tutkimukset solulinjoissa ovat osoittaneet, että imatinibiresistenssi voi johtua osittain P-glykoproteiinin ulosvirtauspumpun ilmentymisen lisääntymisestä . Imatinibiherkkyys on palautettu joissakin tapauksissa käyttämällä P-glykoproteiiniaktiivisuutta estäviä aineita.
Lääkkeiden tuonti orgaanisilla kationikuljettajilla 1
Imatinibin pääsy soluihin riippuu orgaanisesta kationin kuljettajasta ( OCT1 ). OCT1: llä on merkittävä rooli imatinibiresistenssissä estämällä sen sisäänvirtausta ja siten vähentämällä imatinibin solunsisäistä hyötyosuutta. Potilailla, joilla OCT1: n ilmentyminen, aktiivisuus tai polymorfismi oli heikkoa, imatinibin solunsisäiset tasot olivat huomattavasti alhaisemmat. Potilaiden vaste, joilla oli matala OCT1-aktiivisuus, oli merkittävästi annosriippuvainen. Nämä tiedot osoittavat, että OCT1-aktiivisuus on tärkeä determinantti molekyylivasteessa imatinibille.
Vaihtoehtoinen signalointireitin aktivointi
Muutamissa potilasryhmissä resistenssin voi aiheuttaa muiden signalointireittien, erityisesti Src-perheen kinaasien, aktivoituminen. Src-perheen kinaasit on liitetty Bcr-Abl-signalointiin ja välittävät imatinibiresistenssiä stabiloimalla Bcr-Abl: n, konformaation, joka ei sitoudu imatinibiin, aktiivista konformaatiota. Lisäksi lisääntyvä näyttö viittaa siihen, että Src-perheen kinaasit ovat mukana myös Bcr-Abl-riippumattomissa imatinibiresistenssin muodoissa.
Ratkaisut
Imatinibiresistenttien tai sietämättömien CML- potilaiden hoitovaihtoehdot voivat sisältää strategioita, kuten imatinibiannoksen nostaminen tai toisen sukupolven lääkkeiden käyttö. Imatinibiannosten eskaloituminen on osoittanut voittavan jotkut primäärisen resistenssin tapauksista imatinibille, kuten Bcr-Abl-päällekkäisyydet, mutta vaste on yleensä lyhytvaikutteinen. Resistenssin tai suvaitsemattomuuden tapauksessa voi olla hyödyllistä testata Bcr-Abl-mutaatioita toisen linjan hoidon valinnan ohjaamiseksi, koska vaihtelevilla vaihtoehdoilla on erilainen toimintaprofiili eri resistenssimekanismeja vastaan. Toisen sukupolven lääkkeet tarjoavat paremman tehon ja suuremman todennäköisyyden menestyä resistentteillä potilailla. On myös kasvava kiinnostus testata hypoteesia, jonka mukaan useiden Abl-kinaasin estäjien antamista varhaisvaiheen potilailla voitaisiin käyttää lääkeresistenttien kloonien syntymisen viivästyttämiseen tai estämiseen . Kahden aineen yhdistelmä, joka kohdistuu CML: n eri reitteihin , voi parantaa merkittävästi vasteprosentteja ja mahdollisesti lisätä selviytymistä.
Toisen sukupolven lääkkeet
Toisen sukupolven lääkkeillä on alennettu vastustuskyky ja suvaitsemattomuus kuin imatinibilla. Toisen sukupolven lääkkeitä, joita tällä hetkellä markkinoidaan, ovat nilotinibi, dasatinibi, bosutinibi ja ponatinibi.
Nilotinibi (AMN107)
Kehitys
Nilotinibi on fenyyliaminopyrimidiinijohdannainen, joka on rakenteellisesti sukua imatinibille. Se kehitettiin Abl-imatinibikompleksin rakenteen perusteella vastaamaan imatinibi-intoleranssiin ja -resistenssiin liittyvään tarpeeseen. Pieniä muutoksia tehtiin imatinibi molekyyli, jotta se olisi tehokas ja selektiivinen kuin Bcr-Abl-estäjän ja nämä muutokset johtivat löytö Nilotinibin. Nilotinibi on selektiivinen Bcr-Abl-kinaasin estäjä.
Nilotinib on 10-30 kertaa voimakkaampi kuin imatinibin estävä aktiivisuus Bcr-Abl-tyrosiinikinaasin ja leviämisen Bcr-Abl-ilmentäviä soluja. Lääke estää tehokkaasti Bcr-Abl: n automaattisen fosforylaation Tyr- 177: llä, joka on mukana CML-patogeneesissä. Imatinibin ja nilotinibin synergististä aktiivisuutta on raportoitu yhteiskäytön jälkeen. Tämä voi johtua siitä, että lääkkeet imeytyvät soluihin eri mekanismeilla: imatinibivirta riippuu OCT1: stä, mutta nilotinibi ei. Nilotinibi ei myöskään ole substraatti ulosvirtauksen kuljettaja P-glykoproteiinipumpulle, toisin kuin imatinibi. Vaikka näiden kahden lääkkeen kaksiulotteiset molekyylirakenteet saattavat näyttää samanlaisilta, ne ovat toisistaan poikkeavia spatiaalisen rakenteen ja molekyyliominaisuuksien suhteen.

Sitova
Nilotinibi sitoutuu Abl-kinaasidomeenin inaktiiviseen konformaatioon pääosin lipofiilisten vuorovaikutusten kautta ja estää siten sen katalyyttisen aktiivisuuden. Nilotinibi sitoutuu kinaasidomeeniin tekemällä neljä vetysidosvuorovaikutusta, joihin sisältyy Met-318: n pyridyyli- N ja selkäranka NH, anilino- NH ja Thr-315: n sivuketju OH, Glu: n amido-NH ja sivuketjun karboksylaatti. -286 ja amidikarbonyyli Asp-381: n rungon NH kanssa. Nilotinibin [4- (3-pyridinyyli) -2-pyrimidinyyli] aniliinosegmentillä on läheiset sitoutumisvuorovaikutukset ATP: n sitoutumiskohdan alueen Met-318-, Phe-317- ja Thr-315-tähteiden kanssa. Loput puolet yhdisteestä ulottuu Thr-315-portinvartijan jäännöksen yli sitoutumaan ylimääräiseen taskuun. Nilotinibin 3-metyyli-imidatsoli- ja trifluorimetyyliryhmät tekevät tärkeitä vuorovaikutuksia Abl-kinaasidomeenin kanssa. Nämä ryhmät tekevät myös nilotinibin muodosta hyvin erilaisen kuin imatinibin. Nilotinibi sitoutuu myös kinaasiin suuren määrän heikkoja van der Waalsin vuorovaikutuksia.
Vastus
Nilotinibi on osoittanut vaikutusta useimpiin mutaatioihin (32/33), jotka liittyvät imatinibiresistenssiin, mutta T315I-mutantti pysyy resistenttinä nilotinibille. Sen tehottomuus T315I-mutanttia vastaan näyttää johtuvan treoniini-O: n ja aniliini-NH: n välisen H-sidosvuorovaikutuksen menetyksestä nilotinibilla ja steriilistä yhteenotosta isoleusiini-metyyliryhmän ja nilotinibin 2-metyylifenyylifenyyliryhmän välillä. Toisaalta resistenssi nilotinibille liittyy rajoitettuun spektriin Bcr-Abl-kinaasimutaatioita, jotka vaikuttavat enimmäkseen P-silmukkaan ja T315I: hen. Kaikki mutaatiot paitsi T315I estettiin tehokkaasti lisäämällä nilotinibipitoisuutta. Vaikka nilotinibi on voimakkaampi kuin imatinibi, on mahdollista, että sen spesifinen sitoutumistapa Abl: ään voi tehdä muut alueet alttiiksi uudenlaisille lääkeresistensseille.
Dasatinibi (BMS-354825)
Kehitys
Dasatinibi on tiatsolyyliaminopyrimidiini, jota kehitetään hydrokloridisuolana . Se löydettiin immunosuppressiivisia lääkkeitä koskevalla ohjelmalla, ja se on 325 kertaa tehokkaampi villityypin Bcr-Abl: tä ilmentäviä soluja vastaan kuin imatinibi. Dasatinibi on monikohdennettu Bcr-Abl- ja Src-perheen kinaasien estäjä. Sillä on myös estävä vaikutus ylävirran kinaaseja vastaan.
Sitova
Dasatinibi sitoutuu Abl: ään vähemmän tiukkojen konformaatiovaatimusten kuin imatinibi, joten sillä on lisääntynyt teho, mutta heikentynyt selektiivisyys imatinibiin verrattuna. Dasatinibi sitoo sekä aktiivisen että inaktiivisen Abl-kinaasin konformaation, toisin kuin useimmat muut TKI: t sitoutuvat vain aktiiviseen muotoon. Aktiiviseen konformaatioon kohdistuvat yhdisteet on tunnistettu, mutta sitoutumiskohta kaikissa sadoissa ihmisen proteiinikinaaseissa on hyvin samanlainen. Siksi inaktiivisten konformaatioiden välillä on huomattavasti suurempi mahdollisuus erimielisyyksiin, joten pyrkimykset löytää erittäin selektiivisiä kinaasi-inhibiittoreita kohdistuvat molekyyleihin, jotka sitoutuvat passiiviseen konformaatioon.
Dasatinibilla on joitain nilotinibin kanssa yhteisiä rakenteellisia elementtejä, erityisesti aminopyrimidiini- ja karboksamidiryhmien rinnakkaisuus . Aminotiatsoli segmentti Dasatinibin tekee kaksihampaisen H-liimaus vuorovaikutusta selkärangan CO ja NH Met-318 ja amidi-NH tekee H-sidoksen sivuketjun hapen Thr-315.
Vastus
Koska dasatinibi on Src-perheen kinaasien estäjä, se voi voittaa resistenssin Src-perheen kinaasiaktivaation vuoksi. Koska se ei sitoutu Bcr-Abl: een samalla tiukalla konformaatiovaatimuksella kuin imatinibi, se voi estää kaikki Bcr-Abl-kinaasidomeenimutantit paitsi T315I. Dasatinibi ei myöskään ole monilääkkeiden P-glykoproteiinien ulosvirtauspumppujen kuten imatinibin substraatti. Tämän vuoksi dasatinibi voi olla aktiivinen joillakin potilailla epäonnistumisen jälkeen sekä imatinibin että nilotinibin kanssa. Vaikka dasatinibi on paljon voimakkaampi kuin imatinibi, on mahdollista, kuten nilotinibilla, että sen spesifinen sitoutumistapa Abl: ään voi johtaa uusiin haavoittuviin paikkoihin, jotka voivat antaa uudenlaisia lääkeresistenssejä. Phe317: stä on löydetty mutaatioita, joten se on mahdollinen haavoittuva sivusto tälle lääkkeelle.
Bosutinibi (SKI-606)
Kehitys
Bosutinibin rakenne perustuu kinoliinitelineeseen ja liittyy rakenteellisesti AstraZenecan kinatsoliinimalliin . Src-kinaasi riippuvainen hiiva seulonta johti luonnehdintaan 4-anilino-3-kinoliini karbonitriili kuin Src-estäjällä. Tämän osuman ja siihen liittyvän yhdisteen ominaisuuksien yhdistäminen ja liukenevien ryhmien kiinnittyminen johti bosutinibin löytämiseen. Sen ehdotettiin olevan Abl-kinaasin estäjä ja testattuna sellaisenaan se osoittautui hieman voimakkaammaksi Abl: tä kuin Src: tä vastaan ( IC50 1,4 nM vs. 3,5 nM ). Bosutinibin aktiivisuutta kuvattiin ensimmäisen kerran vuonna 2001 ja se esiteltiin Abl-kinaasin estäjänä vuonna 2003. Aluksi uskottiin, että bosutinibi oli selektiivinen Src-kinaasin estäjä, mutta nyt tiedetään, että sen kinaasin estoprofiili on paljon vähemmän rajoitettu kuin alun perin ajateltiin. Bosutinibi estää Src: tä, Abl: ää ja laajaa valikoimaa sekä tyrosiini- että seriini- treoniinikinaaseja.
Vastus
Bosutinibi inhiboi soluja, jotka ilmentävät erilaisia mutaatioita, joista osa johti imatinibiresistenssiin, mutta T315-mutaatio oli täysin resistentti bosutinibille. Toisin kuin imatinibi, nilotinibi ja dasatinibi, bosutinibi ei ole tehokas substraatti monilääkeresistenssin (MDR) kuljettajille, joka edistää vieraiden molekyylien ulosvirtausta soluista. Bosutinibi jopa estää näitä kuljettajaproteiineja suuremmissa pitoisuuksissa.
Ponatinibi (AP24534)
ARIAD Pharmaceuticals , Inc. ilmoitti 10. syyskuuta 2010, että ponatinibi , oraalisesti aktiivinen Bcr-Abl TKI, tehokas T315I-mutaatiota vastaan, oli hyväksytty kliinisen vaiheen II tutkimukseen.
Tietä löytöön voidaan liittää AP23464: ään, joka on yksi ensimmäisistä Ariadin ATP-kilpailevista kaksois-Src / Abl-estäjistä. AP23464 tunnistettiin käyttämällä rakennepohjaisen lääkeaineen suunnittelua ja trisubstituoitujen puriinianalogien kohdennettuja synteettisiä kirjastoja . Aine estää voimakkaasti nanomolaarisessa mittakaavassa Src- ja Bcr-Abl-kinaaseja, mukaan lukien monia yleisiä imatinibiresistenttejä Bcr-Abl-mutaatioita. AP23464 ei kuitenkaan estä T315I-mutaatiota, kun taas AP24534 (ponatinibi).
Kehitys
Ariad käytti erittäin voimakasta lääkeainetta AP23464 tutkiakseen edelleen puriinisydämen templaattien estämismahdollisuuksia kaksois-Src / Abl-estäjille. Ensinnäkin, etsimällä aineita, jotka ovat tehokkaita Abl: n inaktiivisessa konformaatiossa, puriinisydämessä olevaan typpiin sitoutunut sivuketju korvattiin di- aryyliamidirakenteella , jonka tiedettiin olevan erittäin affiniteettia inaktiiviseen konformaatioon muodostamalla ratkaisevia vetysidoksia täyttämällä hydrofobiset taskut kinaasilla. Lisäksi määritettiin, että puriinisydämen syklopentyyliryhmä törmäsi tuossa vahvistuksessa glysiinipitoisella P-silmukalla ja poistettiin siten molekyylistä. Sitten inhiboivan aktiivisuuden ja in vivo oraalisen imeytymisen määrityksissä in vitro -testeillä lipofiilisemmällä, amidiin sitoutuneella syklopropyyliryhmällä C6: lla puriinisydämessä havaittiin olevan sekä tyydyttävä farmakokinetiikka että tehokkuus. Lopuksi diaryyliamidin sivuketjun modifikaatiot lisäämällä imidatsoliliitteitä innoittivat sitten vasta vapautunut nilotinibirakenne. Nämä muutokset johtivat niin sanottuun AP24163: een. Tämän kehitysjakson aikana Ariad testasi useita aineita soluilla, jotka oli transfektoitu T315I-mutatoidulla Bcr-Abl-kinaasilla, ja yllättäen havaittiin, että AP24163 osoitti kohtuullisen inhiboivan vaikutuksen natiivin Bcr-Abl: n voimakkaan estämisen lisäksi.
Tuon läpimurron jälkeen Ariad aloitti lisätutkimuksen yhdisteen AP24163 tehokkuuden lisäämiseksi T315I-mutaatiota vastaan. Molekyylin telakointi T315I-mutatoidun Bcr-Abl-kinaasin ATP-sitoutumiskohtaan paljasti, että odotettua steeristä törmäystä isoleusiinin kanssa ei ollut läsnä, koska puriinisydämen ja diaryyliamidin sivuketjun välillä oli vähemmän steerisesti vaativaa vinyylisidosta verrattuna muihin TKI: iin. Ensimmäinen askel oli yrittää löytää vielä vähemmän steerisesti vaativa rakenne. Ensin testattiin asetyleenisidos , joka johti suurempaan tehoon, mutta epäedulliseen farmakokinetiikkaan. Myöhemmin valittiin vakaampi 2-butyni- sidos. Tämän sidoksen saavuttamiseksi imidatsoli [1,2-a] pyridiinisydämää käytettiin lähtöaineena Sonogashira- reaktiossa; mutta farmakokinetiikka oli silti heikkoa. Kun kehitettiin AP24163, syklopropaanin sivuketjun lisääminen C8: een puriinisydämessä johti suotuisaan farmakokinetiikkaan. Sitten testattiin useita erilaisia sivuketjuja, mutta parhaat tulokset saatiin ilman sivuketjua ollenkaan, jolloin tuloksena oli aine, jolla oli tyydyttävä farmakokinetiikka, mutta nyt alentunut teho myös T315I: tä vastaan. Ensimmäinen askel potenssin lisäämisessä oli tarkastella muita TKI: itä. Imatinibilla on terminaalinen metyylipiperatsiiniryhmä, jonka on osoitettu muodostavan vetysidoksen jäännöksen Ile-360 karbonyylihappiatomin kanssa Abl-kinaasin aktivointisilmukassa. Piperatsiinirengas on myös yleinen liukeneva ryhmä, joka voisi edelleen parantaa molekyylin farmakokineettisiä ominaisuuksia. Nämä spekulaatiot vahvistettiin kaksinkertaistamalla estovaikutus Bcr-Abl T315I -mutoitunutta kinaasia vastaan, ja hopeapäällyste oli aineen (nimeltään '19a' ') sitoutuminen plasman proteiineihin näytti vähentyneen, jolloin pienemmät annokset saivat saman teho. Vaikka '19a': lla oli hyvä oraalinen farmakokinetiikka sekä hiirillä että rotilla, se säilytti myös korkean jakautumiskertoimen 6,69: ssä. Joten, yritettäessä vähentää molekyylin lipofiilisyyttä edelleen, yhden hiiliatomin korvaaminen imidatso [1,2-a] pyridiinisydämessä tehtiin; mikä johti nykyisin yhdisteeksi ponatinibi.
Sitova
Ponatinibin ja T315I Bcr-Abl: n mutatoidun kinaasin röntgenkristallografinen analyysi osoittaa, että imidatso [1,2b] pyridatsiinisydän lepää entsyymin adeniinitaskussa. Metyylifenyyliryhmällä on hydrofobinen tasku I315: n takana, etynyylisidos muodostaa suotuisat van der Waalsin vuorovaikutukset aminohapon kanssa ja trifluorimetyyliryhmä sitoutuu passiivisen konformaatiokinaasin indusoimaan taskuun. Myös ponatinbin lepäävän kinaasin konformaatiossa on muita suotuisampia van der Waalsin vuorovaikutuksia lääkkeen ja Tyr-253: n ja Phe-382: n välillä. Muodostetaan viisi vetysidosta Met-318: n rungon sarana-alueella, Asp-381: n rungon, Glu-286: n sivuketjun ja protonoidun metyylipiperatsiinin kanssa Ile-360: n ja His: n runkokarbonyyliatomien kanssa. -361.
Tässä rakenteessa ponatinibilla on osoitettu olevan suhteellisen laaja kinaasispesifisyysprofiili, joka voidaan todennäköisesti liittää molekyylin kytkentäosan lineaarisuuteen. Tällä lineaarisella rakenteella lääke näyttää välttävän steerisiä törmäyksiä hydrofobisten TK-portinvartijajäämien kanssa. Huolimatta siitä tai jopa tästä johtuen ponatinibi on voimakas lääke, ja se ei kohdistu pelkästään suurimpaan osaan Bcr-Abl TK: n tunnetuista mutaatioista, mutta mikä tärkeintä, T315I. Tämä mutaatio on nousemassa yleiseksi poluksi epäonnistumiseen sekä ensimmäisen että toisen linjan hoidoissa. Toisin kuin muut kehityksessä olevat T315I: n estäjät, ponatinibi ei kohdista Aurora-kinaaseja, mikä erottaa ne selvästi niistä ja korostaa sen löytämisen merkitystä.
Bafetinibi (INNO-406)
Imatinibihoidon vastustuskyvyn alettua sen aloittamisen jälkeen oli erittäin toivottu vaihtoehtoinen hoito. Bafetinibi oli jälkeläinen yritykselle luoda imatinibia tehokkaampi lääke, jolla oli tehoa Bcr-Abl-kinaasin erilaisia pistemutaatioita vastaan, vähäisiä haittavaikutuksia ja kapeammat kinaasispektrit, nimittäin vain Lyn ja Bcr-Abl.
Kehitys
Mainittujen kriteerien mukaisen aineen etsinnässä tutkittiin Abl: ään sitoutuneen imatinibin kiderakennetta. Tämä paljasti hydrofobisen taskun fenyylirenkaan ympärillä imatinibin piperatsinyylimetyyliryhmän vieressä. Yritykset käyttää tätä taskua tehokkuuden lisäämiseksi johtivat erilaisten hydrofobisten ryhmien lisäämiseen, mukaan lukien yksittäiset fluori- , bromi- ja kloorisubstituentit . Lopuksi trifluorimetyyliryhmän asemassa 3 havaittiin tuottavan parhaat tulokset, noin 36-kertaisella parannuksella imatinibiin verrattuna. Hydrofobisen ryhmän lisäämistä oli nyt torjuttava aineen liukoisuuden ylläpitämiseksi. Imatinibikinaasikompleksin kristallirakenteen tarkempi tarkastelu paljasti, että Tyr-236 oli lähellä imatinibin pyridiinirengasta, mikä viittaa siihen, että siellä ei ollut juurikaan tilaa suuremmalle ryhmälle. Tässä mielessä pyridiinille korvattiin hydrofiilisempi pyrimidiinirengas, jonka havaittiin lisäävän liukoisuutta samalla kun tehokkuus jätettiin samaksi tai jopa hieman korkeammaksi. Lopuksi imatinibin piperatsiinirenkaan ja Ile-360: n ja His-361: n vetysidoksen parantamiseksi lisättiin pyrrolidiini- ja atsetidiinijohdannaisia. Lupaavin aine näistä lopullisista muunnoksista oli merkitty NS-187: llä.
Sitova
Imatinibin ja bafetinibin rakenteellisten samankaltaisuuksien vuoksi niiden sitoutuminen Bcr-Abl: ään on myös melko samanlainen. Ainoa merkittävä ero tulee hydrofobisesta vuorovaikutuksesta trifluorimetyyliryhmän ja Ile-293: n, Leu-298: n, Leu-354: n ja Val-379: n luoman hydrofobisen taskun välillä. Tämä ryhmä voidaan liittää myös bafetinibin spesifisyyteen Lynille, koska sitoutumispaikka on melkein identtinen Bcr-Abl: n kanssa.
Bafetinibilla on paikkansa TKI-hoidossa, koska se on tehokas sekä useimpia imatinibiresistenttejä mutaatioita (lukuun ottamatta T315I) että joitain dasatinibiresistenttejä mutaatioita vastaan. Bafetinibilla on myös enemmän affiniteettia Bcr-Abl: ään kuin nilotinibiin (mutta vähemmän kuin dasatinibi), mutta se kohdistuu vain Bcr-Abl- ja Src-perheen kinaaseihin Lck ja Lyn; vertaansa vailla olevalla spesifisyydellä, mikä viittaa vähemmän haitallisten vaikutusten todennäköisyyteen.
CytRx: llä on bafetinbia vaiheen II kliinisessä tutkimuksessa leukemian hoitona toukokuusta 2010 lähtien.
1,3,4 tiadiatsolijohdannaiset - Aine 14
Jonkin verran kiinnostusta on ollut tiatsoli- ja tiadiatsolijohdannaisiin ja niiden kykyyn estää Bcr-Abl-TK: ita.
Kehitys
Yksi italialainen tutkimusryhmä havaitsi digitaalisen seulonnan avulla, että kaupallisesti saatavilla tiadiatsolijohdannaisilla oli kohtalainen estävä vaikutus sekä Abl- että Src-kinaaseihin. Käyttäen 1,3,4-tiadiatsoliydintä ja kokeilemalla erilaisia ryhmiä tai molekyylejä bentseenirenkaissa, tuotettiin useita erilaisia aineita, joilla oli inhiboivia ominaisuuksia. Ytimen joustavuus antoi monien aineiden konformaatioiden sitoutua Abl-kinaasin ATP-kohtaan, vaikka ne kaikki sitoutuivat kinaasin aktiiviseen muotoon. Sitoutumisen jatkotutkimus osoitti, että tolueenirakenteeseen sitoutuvan rikin asemalla oli tärkeä rooli Abl-sitoutumisen suhteen ja että vain yksi typen yhdestä tiadiatsolista muodosti vetysidoksen. Lisäksi rakenteen tietokoneanalyysi osoitti, että amidiin kytketty bentseeni-ketoni voidaan korvata edullisemmalla tiofeenirenkaalla . Vaikka on huomattava, että tämä analyysi tehtiin vertaamalla Abl: n ja dasatinibin kiderakennetta, joka on Abl: n inaktiivinen konformaatio, telakoitumisesta ja rakenneanalyysistä saatu tieto johti yhdisteen, jota kutsutaan aineeksi 14, tunnistamiseen, jolla on suuri affiniteetti Abl: ään.
Sitova
Aineen 14 sitoutuminen on osittain samanlainen kuin dasatinibi, aineen 14 aminotiatsolisegmentti muodostaa kaksitahoisen H-sidoksen vuorovaikutuksen Met-318: n rungon CO: n ja NH: n kanssa, kun taas metoksibentseeni putoaa hienosti Valin luomaan hydrofobiseen taskuun 256, Ala 253, Lys 271 ja Ala 380. Vaikka samat sitoutumisominaisuudet kuin dasatinibilla, viittaa mahdollisuuteen tuottaa Bcr-Abl TKI: itä tiatsolisydämistä on todellinen, on edelleen avoin kysymys, johtaako tämä tutkimus vain dasatinibianalogiin tai uusi tapa estää TK: ita.
Muut
Rebastinibi (DCC-2036) Myös TIE-2: n ja VEGFR-2: n estäjä. Sillä on ollut vaiheen 1 kliininen tutkimus leukemioille (Ph + CML T315I-mutaatiolla). Se on vaiheen 1 kliinisessä tutkimuksessa metastaattisen rintasyövän yhdistelmähoidosta.
Askiminibi (ABL001) on Abriston-kinaasin estäjä, joka kohdistuu myristoyylitaskuun estämään entsyymiä allosteerisesti. Elokuussa 2020 se oli saanut päätökseen vaiheen III tutkimuksen CML: ssä (ASCEMBL), joka osoitti parempaa tehoa kuin bosutinibi.
Yhteenveto
| Lääke | Rakenne | H-sidokset | H-sidos aminohapot | Sitova vahvistus | Löytö | Tilanne vuodesta 2017 |
|---|---|---|---|---|---|---|
| Imatinibi (STI571) |
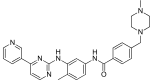
|
6 | Met-318, Thr-315, Glu-286, Asp-381, Ile-380, His-361 | Epäaktiivinen | Huumeiden seulonta | Markkinoidaan ensilinjan terapiana |
| Nilotinibi (AMN107) |

|
4 | Met-318, Thr-315, Glu-286, Asp-381 | Epäaktiivinen | Rationaalinen lääkesuunnittelu | Markkinoidaan toisen linjan hoitona |
| Dasatinibi (BMS-345825) |

|
3 | Met-318, Thr-315 | Aktiivinen | Rationaalinen lääkesuunnittelu | Markkinoidaan toisen linjan hoitona |
| Bosutinibi (SKI-606) |

|
- | - | Epäaktiivinen | Rationaalinen lääkesuunnittelu | Markkinoidaan toisen linjan hoitona |
| Ponatinibi (AP-24534) |

|
5 | Met-318, Asp-381, Glu-286, His-381, Ile-380 | Epäaktiivinen | Rationaalinen lääkesuunnittelu | Markkinoidaan toisen linjan hoitona |
| Bafetinibi (INNO-406) |
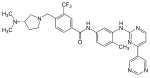
|
6 | Met-318, Thr-315, Glu-286, Asp-381, His-361, Ile-360 | Epäaktiivinen | Rationaalinen lääkesuunnittelu | Markkinoidaan toisen linjan hoitona |
Nykyinen tila - re Ph + CML
Imatinibi on edelleen vakio etulinjan TKI. Nilotinibi ja dasatinibi ovat myös FDA: n hyväksymiä etulinjassa kesäkuussa ja lokakuussa 2010. Neljä näistä lääkkeistä, nilotinibi, dasatinibi, bosutinibi ja ponatinibi, on hyväksytty imatinibiresistentin tai sietämättömän CML: n hoitoon. Näiden yhdisteiden ensilinjan tiedot ovat rohkaisevia ja viittaavat siihen, että jotkut tai kaikki niistä voivat korvata imatinibin etulinjan standardina TKI: nä tulevaisuudessa.








