Hemodialyysi - Hemodialysis
| Hemodialyysi | |
|---|---|
 Hemodialyysikone
| |
| Muut nimet | munuaisdialyysi |
| Erikoisuus | nefrologia |
Hemodialyysi , myös speltti -hemodialyysi tai yksinkertaisesti dialyysi , on prosessi, jolla puhdistetaan sellaisen henkilön veri, jonka munuaiset eivät toimi normaalisti. Tämäntyyppisellä dialyysillä saavutetaan kehon ulkopuoliset jätteet, kuten kreatiniini ja urea, sekä vapaa vesi verestä, kun munuaiset ovat munuaisten vajaatoiminnassa . Hemodialyysi on yksi kolmesta munuaisten korvaushoidosta (kaksi muuta ovat munuaisensiirto ja peritoneaalidialyysi ). Vaihtoehtoinen menetelmä veren komponenttien, kuten plasman tai solujen, kehonulkoiseen erottamiseen on afereesi .
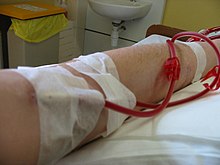
Hemodialyysi voi olla avo- tai sairaalahoitoa . Säännöllinen hemodialyysi suoritetaan dialyysipotilaassa, joko tarkoitukseen rakennetussa huoneessa sairaalassa tai erillisessä klinikassa. Hemodialyysi tehdään harvemmin kotona . Dialyysihoitoja klinikalla käynnistää ja hallinnoi sairaanhoitajista ja teknikoista koostuva erikoishenkilöstö; dialyysihoidot kotona voidaan aloittaa itse ja hoitaa tai tehdä yhdessä koulutetun avustajan avulla, joka on yleensä perheenjäsen.
Lääketieteellinen käyttö
Hemodialyysi on munuaisten korvaushoidon valinta potilaille, jotka tarvitsevat akuuttia dialyysihoitoa, ja monille potilaille ylläpitohoitona. Se tarjoaa erinomaisen ja nopean puhdistuksen liuenneista aineista.
Nephrologist (lääkärin munuainen erikoislääkärin) päättää, milloin hemodialyysiä tarvitaan ja erilaiset parametrit dialyysihoidon. Näitä ovat taajuus (kuinka monta hoitoa viikossa), kunkin hoidon pituus ja veren ja dialyysiliuoksen virtausnopeudet sekä dialysaattorin koko. Dialyysiliuoksen koostumusta säädetään joskus myös sen natrium-, kalium- ja bikarbonaattitasojen suhteen. Yleensä mitä suurempi yksilön kehon koko, sitä enemmän hän tarvitsee dialyysiä. Vuonna Pohjois-Amerikassa ja Britanniassa , 3-4 tunnin hoidot (joskus jopa 5 tuntia suuremmille potilasta) annettiin 3 kertaa viikossa ovat tyypillisiä. Kaksi kertaa viikossa istunnot rajoittuvat potilaisiin, joilla on merkittävä jäljellä oleva munuaisten toiminta. Neljä istuntoa viikossa määrätään usein suuremmille potilaille sekä potilaille, joilla on ongelmia nesteen ylikuormituksen kanssa . Lopuksi kiinnostus lyhytaikaiseen päivittäiseen koti -hemodialyysiin , joka on 1,5 - 4 tunnin istunto, annetaan 5-7 kertaa viikossa, yleensä kotona. Kiinnostusta herättää myös yöllinen dialyysi , johon kuuluu potilaan dialyysi , yleensä kotona, 8–10 tuntia per yö, 3–6 yötä viikossa. Yöllisiä-keskus dialyysi, 3-4 kertaa viikossa, on tarjolla myös kourallinen dialyysin yksiköiden Yhdysvalloissa .
Haittavaikutukset
Haitat
- Rajoittaa riippumattomuutta, koska tämän menettelyn kohteena olevat ihmiset eivät voi matkustaa ympäri tarvikkeiden saatavuuden vuoksi
- Vaatii lisää tarvikkeita, kuten korkeaa vedenlaatua ja sähköä
- Vaatii luotettavaa tekniikkaa, kuten dialyysikoneita
- Menettely on monimutkainen ja vaatii hoitajilta enemmän tietoa
- Vaatii aikaa dialyysikoneiden asentamiseen ja puhdistamiseen sekä kustannuksia koneiden ja niihin liittyvän henkilökunnan kanssa
Komplikaatiot
Nesteiden vaihto
Hemodialyysi sisältää usein nesteen poistamisen ( ultrasuodatuksen kautta ), koska useimmat munuaisten vajaatoimintaa sairastavat potilaat virtsavat vähän tai eivät ollenkaan. Sivuvaikutuksia, jotka aiheutuvat liiallisen nesteen poistamisesta ja/tai nesteen poistamisesta liian nopeasti, ovat alhainen verenpaine , väsymys , rintakipu, jalkakrampit, pahoinvointi ja päänsärky . Nämä oireet voivat ilmetä hoidon aikana ja voivat jatkua hoidon jälkeen; niitä kutsutaan joskus yhdessä dialyysin krapulaksi tai dialyysipesuksi. Näiden oireiden vakavuus on yleensä verrannollinen nesteen poiston määrään ja nopeuteen. Tietyn nestemäärän tai -nopeuden vaikutus voi kuitenkin vaihdella suuresti henkilöstä toiseen ja päivittäin. Näitä haittavaikutuksia voidaan välttää ja/tai vähentää niiden vakavuutta rajoittamalla nesteen saantia hoitojen välillä tai lisäämällä dialyysiannosta, esim. Dialysoimalla hoitoa useammin tai pidempään kuin tavanomainen kolme kertaa viikossa, 3-4 tuntia hoitoaikataulua kohti.
Koska hemodialyysi edellyttää pääsyä verenkiertojärjestelmään, hemodialyysipotilaat voivat altistaa verenkiertojärjestelmänsä mikrobille , mikä voi johtaa bakteeriin , sydänläppien tulehdukseen ( endokardiitti ) tai luustoon ( osteomyeliitti ). Tartuntariski vaihtelee käytetyn käyttötavan mukaan (katso alla). Myös verenvuotoa voi esiintyä, taas riski vaihtelee käytetyn käyttötavan mukaan. Infektiot voidaan minimoida noudattamalla tiukasti infektioiden hallinnan parhaita käytäntöjä.
Laskimoneulan siirtyminen
Laskimoneulan siirtyminen (VND) on kohtalokas hemodialyysin komplikaatio, jossa potilas kärsii nopeasta verenhukasta, koska neula on heikosti kiinnittynyt laskimoon.
Fraktioimaton hepariini (UHF) on yleisimmin käytetty antikoagulantti hemodialyysissä, koska se on yleensä hyvin siedetty ja voidaan korjata nopeasti protamiinisulfaatilla . Pienimolekyylipainoinen hepariini (LMWH) on kuitenkin tulossa yhä suositummaksi ja on nyt normi Länsi-Euroopassa. Verrattuna UHF: ään LMWH: n etuna on helpompi antotapa ja vähentynyt verenvuoto, mutta vaikutusta ei voida helposti peruuttaa. Hepariini voi harvoin aiheuttaa alhaisen verihiutaleiden määrän hepariinin aiheuttaman trombosytopenian (HIT) vuoksi . Tällaisilla potilailla voidaan käyttää vaihtoehtoisia antikoagulantteja. HIT -riski on pienempi LMWH: lla verrattuna UHF: ään. Vaikka HIT aiheuttaa alhaisen verihiutaleiden määrän, se voi paradoksaalisesti altistaa tromboosille. Potilailla, joilla on suuri verenvuotoriski, dialyysi voidaan tehdä ilman antikoagulaatiota.
Ensimmäisen käytön oireyhtymä
Ensikäytön oireyhtymä on harvinainen, mutta vakava anafylaktinen reaktio on keinomunuaisessa . Sen oireita ovat aivastelu, hengityksen vinkuminen, hengenahdistus, selkäkipu, rintakipu tai äkillinen kuolema. Se voi johtua keinotekoisen munuaisen jäljellä olevasta sterilointiaineesta tai itse kalvon materiaalista. Viime vuosina ensikäyttöoireyhtymän ilmaantuvuus on vähentynyt johtuen gammasäteilytyksen , höyrysteriloinnin tai elektronisäteilyn käytön lisääntymisestä kemiallisten sterilointiaineiden sijasta ja uusien puoliläpäisevien kalvojen kehittämisestä, joiden biologinen yhteensopivuus on parempi . Uusia menetelmiä aiemmin hyväksyttyjen dialyysikomponenttien käsittelemiseksi on aina harkittava. Esimerkiksi vuonna 2008 tapahtui sarja ensikäyttöisiä reaktioita, mukaan lukien kuolemantapaukset, johtuen hepariinista, joka oli kontaminoitunut valmistusprosessin aikana ylikuumennetulla kondroitiinisulfaatilla .
Sydän ja verisuonisto
Hemodialyysin pitkäaikaisia komplikaatioita ovat hemodialyysiin liittyvä amyloidoosi , neuropatia ja erilaiset sydänsairaudet . Hoidon taajuuden ja keston lisäämisen on osoitettu parantavan nesteen ylikuormitusta ja sydämen laajentumista, jota tavallisesti havaitaan tällaisilla potilailla. Näiden komplikaatioiden vuoksi täydentävän ja vaihtoehtoisen lääketieteen käyttö on yleistä hemodialyysipotilailla.
Vitamiinin puute
Folaatin puutetta voi esiintyä joillakin hemodialyysipotilailla.
Elektrolyyttitasapaino
Vaikka veren suodattamiseen käytetään dyalisaattinesettä, joka on liuos, joka sisältää laimennettuja elektrolyyttejä, hemodialyysi voi aiheuttaa elektrolyyttitasapainon. Nämä epätasapainot voivat johtua epänormaaleista kaliumpitoisuuksista ( hypokalemia , hyperkalemia ) ja natriumista ( hyponatremia , hypernatremia ). Nämä elektrolyyttitasapainot liittyvät lisääntyneeseen sydän- ja verisuonikuolleisuuteen.
Mekanismi ja tekniikka
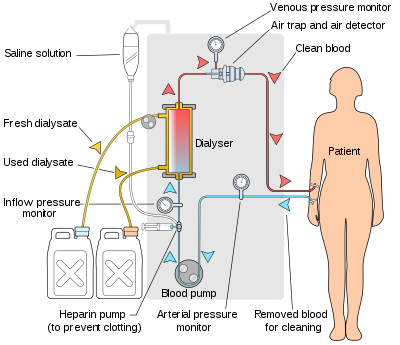
Hemodialyysin periaate on sama kuin muidenkin dialyysimenetelmien ; siihen liittyy liuenneiden aineiden diffuusio puoliläpäisevän kalvon poikki. Hemodialyysi käytetään vastavirtavirtauksessa , jossa dialysaatti virtaa vastakkaiseen suuntaan veren virtaus on kehonulkoisen piirin. Vastavirtaus pitää pitoisuusgradientin kalvon poikki maksimissaan ja lisää dialyysin tehokkuutta.
Nesteen poisto ( ultrasuodatus ) saavutetaan muuttamalla dialysaattitilan hydrostaattista painetta , jolloin vapaa vesi ja jotkut liuenneet liuenneet aineet liikkuvat kalvon läpi luotua painegradienttia pitkin.
Käytettävä dialyysiliuos voi olla steriloitu mineraali -ioniliuos ja sitä kutsutaan dialysaatiksi. Urea ja muut jätteet, mukaan lukien kalium ja fosfaatti, diffundoituvat dialyysiliuokseen. Kuitenkin natriumin ja kloridin pitoisuudet ovat samankaltaiset kuin normaalissa plasmassa häviämisen estämiseksi. Natriumbikarbonaattia lisätään plasmaa korkeammassa pitoisuudessa veren happamuuden korjaamiseksi. Pieni määrä glukoosia käytetään myös yleisesti. Elektrolyyttien pitoisuus dialysaatissa säädetään potilaan tilan mukaan ennen dialyysiä. Jos dialysaattiin lisätään suuri määrä natriumia, potilas voi janoa ja kerääntyä kehon nesteitä, mikä voi johtaa sydämen vaurioitumiseen. Päinvastoin, alhaiset natriumpitoisuudet dialysaattiliuoksessa on yhdistetty alhaiseen verenpaineeseen ja intradialyyttiseen painonnousuun, jotka ovat parannettujen tulosten merkkejä. Alhaisen natriumpitoisuuden käytön hyötyjä ei kuitenkaan ole vielä osoitettu, koska nämä potilaat voivat myös kärsiä kouristuksista, intraradiaalisesta hypotensiosta ja alhaisesta seerumin natriumista, jotka ovat oireita, jotka liittyvät korkeaan kuolleisuusriskiin.
Huomaa, että tämä on erilainen prosessi kuin asiaan liittyvä hemofiltraatiotekniikka .
Pääsy
Veren saamiseksi hemodialyysiä varten käytetään kolmea ensisijaista menetelmää: suonensisäinen katetri, valtimo -fisteli (AV) ja synteettinen siirte. Pääsytyyppiin vaikuttavat sellaiset tekijät kuin potilaan munuaisten vajaatoiminnan odotettu kuluminen ja verisuoniston kunto. Potilailla voi olla useita pääsymenettelyjä, yleensä siksi, että AV -fisteli tai siirte kypsyy ja katetria käytetään edelleen. Katetrin sijoittaminen tapahtuu yleensä kevyellä sedaatiolla, kun taas fistulat ja siirteet vaativat leikkausta.
Tyypit
Hemodialyysiä on kolme tyyppiä: tavanomainen hemodialyysi, päivittäinen hemodialyysi ja öinen hemodialyysi. Alla on mukautus ja yhteenveto Ottawan sairaalan esitteestä.
Perinteinen hemodialyysi
Perinteinen hemodialyysi tehdään yleensä kolme kertaa viikossa, noin kolmesta neljään tuntiin kutakin hoitoa kohden (joskus viisi tuntia suuremmille potilaille), jonka aikana potilaan veri vedetään putken läpi nopeudella 200–400 ml/min. Putki on yhdistetty 15, 16, tai 17 gaugen neula asetettuna dialyysin fisteli tai siirteen tai liitetty yhteen porttiin dialyysin katetrin . Veri pumpataan sitten dialysaattorin läpi ja sitten käsitelty veri pumpataan takaisin potilaan verenkiertoon toisen putken kautta (joka on liitetty toiseen neulaan tai porttiin). Toimenpiteen aikana potilaan verenpainetta seurataan tarkasti, ja jos se laskee tai potilaalle kehittyy muita merkkejä alhaisesta veren tilavuudesta, kuten pahoinvointi, dialyysihoitaja voi antaa ylimääräistä nestettä koneen läpi. Hoidon aikana potilaan koko veren tilavuus (noin 5000 cm3) kiertää koneen läpi 15 minuutin välein. Tämän prosessin aikana dialyysipotilas altistuu keskimääräiselle ihmiselle viikon vedelle.
Päivittäinen hemodialyysi
Päivittäistä hemodialyysiä käyttävät tyypillisesti ne potilaat, jotka tekevät oman dialyysin kotona. Se on vähemmän stressaavaa (lempeämpää), mutta vaatii useamman pääsyn. Tämä on yksinkertaista katetrien kanssa, mutta ongelmallisempaa fistulien tai siirteiden kanssa. "Napinläven tekniikkaa" voidaan käyttää fistuloihin, jotka vaativat usein pääsyä. Päivittäinen hemodialyysi tehdään yleensä 2 tuntia kuutena päivänä viikossa.
Öinen hemodialyysi
Yön hemodialyysi on samanlainen kuin tavanomainen hemodialyysi, paitsi että se suoritetaan kolmesta kuuteen yötä viikossa ja kuudesta kymmeneen tuntia istuntoa kohti potilaan nukkuessa.
Laitteet
Hemodialyysikone pumppaa potilaan verta ja dialysaattia dialysaattorin läpi. Markkinoiden uusimmat dialyysikoneet ovat erittäin tietokoneistettuja ja valvovat jatkuvasti joukkoa turvallisuuden kannalta tärkeitä parametreja, mukaan lukien veren ja dialysaatin virtausnopeudet; dialyysiliuoksen johtavuus, lämpötila ja pH; ja dialysaatin analyysi verenvuodon tai ilman läsnäolon varalta. Kaikki lukemat, jotka ovat normaalin alueen ulkopuolella, laukaisevat äänihälytyksen, joka varoittaa potilasta hoitavaa teknikkoa. Dialyysikoneiden valmistajia ovat mm. Nipro , Fresenius , Gambro , Baxter, B. Braun , NxStage ja Bellco.
Vesijärjestelmä
Laaja vedenpuhdistusjärjestelmä on ehdottoman tärkeä hemodialyysin kannalta. Koska dialyysipotilaat altistuvat suurille määrille vettä, joka sekoitetaan dialysaattikonsentraatin kanssa dialysaatin muodostamiseksi, jopa pienet kivennäisaineet tai bakteeri -endotoksiinit voivat suodattua potilaan vereen. Koska vaurioituneet munuaiset eivät pysty suorittamaan aiottua tehtäväänsä epäpuhtauksien poistamiseksi, veden kautta verenkiertoon tulevat ionit voivat kerääntyä vaarallisille tasoille aiheuttaen lukuisia oireita tai kuoleman . Alumiini, kloramiini , fluoridi, kupari ja sinkki sekä bakteerifragmentit ja endotoksiinit ovat kaikki aiheuttaneet ongelmia tässä suhteessa.
Tästä syystä hemodialyysissä käytetty vesi puhdistetaan huolellisesti ennen käyttöä. Aluksi se suodatetaan ja lämpötilaa säädetään ja sen pH korjataan lisäämällä happoa tai emästä. Vaihtoehtoisesti voidaan lisätä kemiallisia puskureita, kuten bikarbonaattia ja laktaattia dialysaatin pH: n säätelemiseksi. Molemmat puskurit voivat vakauttaa liuoksen pH: n fysiologisella tasolla ilman negatiivisia vaikutuksia potilaaseen. On jonkin verran näyttöä siitä, että sydän- ja veriongelmien ja korkean verenpaineen esiintyvyys on vähentynyt, kun bikarbonaattia käytetään pH -puskurina verrattuna laktaattiin. Kuolleisuusaste kummankin puskurin käytön jälkeen ei kuitenkaan osoita merkittävää eroa.
Sitten dialysaattiliuos pehmennetään. Seuraavaksi vesi johdetaan aktiivihiiltä sisältävän säiliön läpi orgaanisten epäpuhtauksien adsorboimiseksi . Ensisijainen puhdistus suoritetaan pakottamalla vesi kalvon läpi, jossa on hyvin pienet huokoset, ns. Käänteisosmoosikalvo . Tämä päästää veden kulkemaan, mutta estää jopa hyvin pieniä liuenneita aineita, kuten elektrolyyttejä. Jäljelle jääneet elektrolyytit poistetaan lopulta johtamalla vesi säiliön läpi, jossa on ioninvaihtohartseja, jotka poistavat jäännökset anioneista tai kationeista ja korvaavat ne vastaavasti hydroksyyli- ja vetyioneilla jättäen ultrapuhtaan veden.
Jopa tämä vedenpuhdistusaste voi olla riittämätön. Viime aikoina suuntaus on johtaa tämä lopullinen puhdistettu vesi (dialysaattikonsentraatin kanssa sekoittamisen jälkeen) dialysaattorikalvon läpi. Tämä tarjoaa uuden suojakerroksen poistamalla epäpuhtaudet, erityisesti bakteeriperäiset epäpuhtaudet, jotka ovat saattaneet kerääntyä veteen sen jälkeen, kun se on kulkenut alkuperäisen vedenpuhdistusjärjestelmän läpi.
Kun puhdistettu vesi on sekoitettu dialysaattikonsentraatin kanssa, sen johtavuus kasvaa, koska varautuneita ioneja sisältävä vesi johtaa sähköä. Dialyysin aikana dialyysiliuoksen johtavuutta seurataan jatkuvasti sen varmistamiseksi, että vesi ja dialysaattikonsentraatti sekoittuvat oikeassa suhteessa. Sekä liian väkevä dialyysiliuos että liian laimea liuos voivat aiheuttaa vakavia kliinisiä ongelmia.
Dialysaattori
Dialysaattori on laite, joka todella suodattaa verta. Lähes kaikki nykyään käytettävät dialysaattorit ovat onttoja kuituja. Lieriömäinen onttojen kuitujen kimppu, jonka seinät koostuvat puoliläpäisevästä kalvosta, on ankkuroitu kummastakin päästä ruukkuyhdisteeseen (eräänlainen liima). Tämä kokoonpano asetetaan sitten kirkkaaseen muoviseen lieriömäiseen kuoreen, jossa on neljä aukkoa. Yksi aukko tai veriaukko sylinterin kummassakin päässä on yhteydessä onttojen kuitujen nipun kumpaankin päähän. Tämä muodostaa dialysaattorin "veriosaston". Kaksi muuta aukkoa leikataan sylinterin sivulle. Nämä kommunikoivat onttojen kuitujen ympärillä olevan tilan, "dialysaattitilan" kanssa. Veri pumpataan veriporttien kautta tämän erittäin ohuiden kapillaarimaisten putkien nipun läpi ja dialysaatti pumpataan kuituja ympäröivän tilan läpi. Tarvittaessa käytetään painegradienttia nesteen siirtämiseksi verestä dialysaattilokeroon.
Kalvo ja virtaus
Dialysaattorikalvojen huokoskoko on erilainen. Niitä, joiden huokoskoko on pienempi, kutsutaan "matalan virtauksen" ja niitä, joiden huokoskoko on suurempi, kutsutaan "korkean virtauksen". Joitakin suurempia molekyylejä, kuten beeta-2-mikroglobuliinia, ei poisteta lainkaan pienvirtaisilla dialysaattoreilla; viime aikoina on ollut suuntaus käyttää korkeavirtaisia dialysaattoreita. Tällaiset dialysaattorit vaativat kuitenkin uudempia dialyysikoneita ja korkealaatuista dialyysiliuosta nesteen poistonopeuden säätämiseksi oikein ja estämään dialyysiliuoksen epäpuhtauksien takaisinvirtauksen potilaaseen kalvon läpi.
Dialysaattorikalvot valmistettiin aiemmin pääasiassa selluloosasta (puuvillavuori). Tällaisten kalvojen pinta ei ollut kovin bioyhteensopiva, koska paljastuneet hydroksyyliryhmät aktivoisivat komplementtia kalvon ohitse kulkevassa veressä. Siksi perus-, "substituoimaton" selluloosakalvo muutettiin. Yksi muutos oli kattaa nämä hydroksyyliryhmät asetaattiryhmillä (selluloosa -asetaatti); toinen oli sekoittaa joitakin yhdisteitä, jotka estäisivät komplementaation aktivoitumisen kalvon pinnalla (modifioitu selluloosa). Alkuperäisiä "korvaamattomia selluloosakalvoja" ei enää käytetä laajasti, kun taas selluloosa -asetaattia ja modifioituja selluloosa -dialysaattoreita käytetään edelleen. Selluloosamembraanit voidaan valmistaa joko pienen tai suuren virtauksen kokoonpanossa huokosten koon mukaan.
Toinen kalvoryhmä on valmistettu synteettisistä materiaaleista käyttäen polymeerejä , kuten polyaryylieetterisulfonia , polyamidia , polyvinyylipyrrolidonia , polykarbonaattia ja polyakryylinitriiliä . Nämä synteettiset kalvot aktivoivat komplementtia vähemmän kuin substituoimattomat selluloosakalvot. Ne ovat kuitenkin yleensä hydrofobisempia, mikä johtaa proteiinien lisääntyneeseen adsorptioon kalvon pintaan, mikä puolestaan voi johtaa komplementtisysteemin aktivoitumiseen. Synteettisiä kalvoja voidaan valmistaa joko matala- tai suurivuotokokoonpanossa, mutta useimmat ovat korkeavirtaisia.
Nanoteknologiaa käytetään joissakin viimeisimmistä korkeavirtauskalvoista tasaisen huokoskoon luomiseksi. Suurivirtauskalvojen tavoitteena on siirtää suhteellisen suuria molekyylejä, kuten beeta-2-mikroglobuliini (MW 11 600 daltonia), mutta ei albuminia (MW ~ 66 400 daltonia). Jokaisella kalvolla on erikokoisia huokosia. Kun huokoskoko kasvaa, jotkut suuren virtauksen dialysaattorit alkavat päästää albumiinin siirtymään verestä dialysaattiin. Tämän uskotaan olevan ei-toivottavaa, vaikka eräs ajatuskoulu katsoo, että joidenkin albumiinien poistaminen voi olla hyödyllistä proteiiniin sitoutuneiden ureemisten toksiinien poistamisen kannalta.
Kalvon virtaus ja tulos
Parantaako suuren virtauksen dialysaattorin käyttö potilaan tuloksia on hieman kiistanalainen, mutta useat tärkeät tutkimukset ovat osoittaneet, että sillä on kliinisiä hyötyjä. NIH: n rahoittamassa HEMO-tutkimuksessa verrattiin eloonjäämistä ja sairaalahoitoa dialyysiin satunnaistetuilla potilailla, joilla oli joko alhaisen tai suuren virtauksen kalvot. Vaikka ensisijainen tulos (kaikkien syiden kuolleisuus) ei saavuttanut tilastollista merkitsevyyttä ryhmässä, joka oli satunnaistettu käyttämään korkeavirtaisia kalvoja, useat toissijaiset tulokset olivat parempia korkeavirtausryhmässä. Äskettäinen Cochrane -analyysi totesi, että kalvon valinnan hyötyä tuloksiin ei ole vielä osoitettu. Yhteistyöhön perustuva satunnaistettu tutkimus Euroopasta, MPO (Membrane Permeability Outcomes) -tutkimus, jossa verrattiin kuolleisuutta potilailla, jotka olivat juuri aloittaneet dialyysin käyttämällä joko korkean tai matalan virtauksen kalvoja, havaittiin merkityksetön suuntaus parantaa eloonjäämistä niillä, jotka käyttävät suuren virtauksen kalvoja, ja eloonjäämisetua potilailla, joiden seerumin albumiinipitoisuus on alhaisempi tai diabeetikoilla.
Kalvon virtaus ja beeta-2-mikroglobuliinin amyloidoosi
Suurivuotiset dialyysikalvot ja/tai ajoittainen online-hemodiafiltraatio (IHDF) voivat myös auttaa vähentämään beeta-2-mikroglobuliinin kertymisen komplikaatioita. Koska beeta-2-mikroglobuliini on suuri molekyyli, jonka molekyylipaino on noin 11 600 daltonia, se ei läpäise lainkaan pienvirtaisia dialyysikalvoja. Beeta-2-M poistetaan suurivirtausdialyysillä, mutta se poistetaan vielä tehokkaammin IHDF: llä. Useiden vuosien (yleensä vähintään 5-7) kuluttua hemodialyysipotilaille alkaa kehittyä komplikaatioita beeta-2-M: n kertymisestä, mukaan lukien karpaalikanavan oireyhtymä, luukystat ja tämän amyloidin kerrostumat nivelissä ja muissa kudoksissa. Beeta-2-M-amyloidoosi voi aiheuttaa erittäin vakavia komplikaatioita, mukaan lukien spondyloartropatia , ja se liittyy usein olkanivelongelmiin. Euroopasta ja Japanista tehdyt havainnointitutkimukset ovat ehdottaneet, että korkeavirtauskalvojen käyttäminen dialyysitilassa tai IHDF: ssä vähentää beeta-2-M-komplikaatioita verrattuna tavalliseen dialyysiin, jossa käytetään matalan virtauksen kalvoa.
Dialysaattorin koko ja tehokkuus
Dialysaattoreita on useita eri kokoja. Suurempi dialysaattori, jolla on suurempi kalvopinta -ala (A), poistaa yleensä enemmän liuenneita aineita kuin pienempi dialysaattori, etenkin suurilla veren virtausnopeuksilla. Tämä riippuu myös kalvon läpäisevyyden kerroin K 0 varten liuenneen aineen osalta. Joten dialysaattorin tehokkuus ilmaistaan yleensä K 0 A: na - läpäisevyyskertoimen ja alueen tulona. Useimmat osmoosiolaitteet on kalvon pinta-alat ovat 0,8-2,2 neliömetriä, ja arvot K 0 vaihtelee välillä noin 500-1500 ml / min. K 0 A , ml/min, voidaan ajatella dialysaattorin maksimipuhdistumana erittäin suurilla veren ja dialysaatin virtausnopeuksilla.
Dialysaattorien uudelleenkäyttö
Dialysaattori voidaan joko hävittää jokaisen hoidon jälkeen tai käyttää uudelleen. Uudelleenkäyttö vaatii laajan korkean tason desinfiointimenettelyn. Uudelleenkäytettyjä dialysaattoreita ei jaeta potilaiden kesken. Aluksi syntyi kiistely siitä, pahentaako dialysaattorien uudelleenkäyttö potilaan tuloksia. Nykyään vallitsee yksimielisyys siitä, että dialysaattorien uudelleenkäyttö, jos se tehdään huolellisesti ja oikein, tuottaa samanlaisia tuloksia kuin dialysaattorien kertakäyttö.
Dialyzerin uudelleenkäyttö on käytäntö, joka on ollut käytössä tuotteen keksimisestä lähtien. Tämä käytäntö sisältää käytetyn dialysaattorin puhdistuksen, jota voidaan käyttää uudelleen useita kertoja samalle potilaalle. Dialyysiklinikat käyttävät dialysaattoreita uudelleen taloudellisiksi ja vähentävät kertakäyttöisen dialyysin korkeita kustannuksia, jotka voivat olla erittäin kalliita ja tuhlaavia. Kertakäyttöiset dialysaattorit käynnistetään vain kerran ja heitetään pois, jolloin syntyy suuri määrä lääketieteellistä biojätettä ilman säästöjä kustannussäästöjen vuoksi. Jos se tehdään oikein, dialysaattorin uudelleenkäyttö voi olla erittäin turvallista dialyysipotilaille.
Dialysaattoreita voidaan käyttää uudelleen kahdella tavalla, manuaalisesti ja automaattisesti. Manuaalinen uudelleenkäyttö sisältää dialysaattorin puhdistamisen käsin. Dialysaattori puretaan puoliksi ja huuhdellaan toistuvasti ennen sen huuhtelua vedellä. Sitä säilytetään nestemäisen desinfiointiaineen (PAA) kanssa 18+ tuntia seuraavaan käyttöön saakka. Vaikka monet klinikat Yhdysvaltojen ulkopuolella käyttävät tätä menetelmää, jotkut klinikat siirtyvät kohti automatisoitua/virtaviivaisempaa prosessia dialyysikäytännön edetessä. Uudempi automaattisen uudelleenkäytön menetelmä saavutetaan lääketieteellisellä laitteella, joka alkoi 1980 -luvun alussa. Nämä laitteet ovat hyödyllisiä dialyysiklinikoille, jotka harjoittavat uudelleenkäyttöä - etenkin suurille dialyysikliinisille yksiköille - koska ne mahdollistavat useita selkänojaa päivässä. Teknikko esipuhdistaa dialysaattorin ensin ja puhdistaa sen sitten automaattisesti koneella vaiheittain, kunnes se lopulta täytetään nestemäisellä desinfiointiaineella säilytystä varten. Vaikka automaattinen uudelleenkäyttö on tehokkaampaa kuin manuaalinen uudelleenkäyttö, uudempi tekniikka on lisännyt entisestään edistystä uudelleenkäyttöprosessissa. Kun dialysaattoria käytetään uudelleen yli 15 kertaa nykyisellä menetelmällä, se voi menettää B2m: n, keskimolekyylin puhdistuman ja kuituhuokosrakenteen eheyden, mikä voi heikentää potilaan dialyysi -istunnon tehokkuutta. Tällä hetkellä vuodesta 2010 lähtien uudempi, kehittyneempi uudelleenkäsittelytekniikka on osoittanut kyvyn poistaa manuaalinen esipuhdistusprosessi kokonaan ja on myös osoittanut kyvyn palauttaa (palauttaa) kaikki dialysaattorin toiminnot tasolle, joka vastaa suunnilleen kertakäyttöinen yli 40 syklin ajan. Kun lääketieteellisten korvausten hinnat alkavat laskea entisestään, monet dialyysiklinikat toimivat edelleen tehokkaasti uudelleenkäyttöohjelmilla, varsinkin kun prosessi on aiempaa helpompi ja virtaviivaisempi.
Epidemiologia
Hemodialyysi oli yksi yleisimmistä toimenpiteistä, jotka suoritettiin Yhdysvaltain sairaaloissa vuonna 2011, ja sitä esiintyi 909 000 vierailulla (29 oleskelua 10000 asukasta kohti). Tämä kasvoi 68 prosenttia vuodesta 1997, jolloin oleskeluja oli 473 000. Se oli viidenneksi yleisin toimenpide 45–64 -vuotiaille potilaille.
Historia
Monet ovat olleet mukana kehittämässä dialyysi käytännön hoito munuaisten vajaatoiminnan alkaen Thomas Graham ja Glasgow , joka ensimmäisenä esitti periaatteet liuenneen aineen kuljetuksen puoliläpäisevän kalvon 1854. keinomunuaisessa kehitti ensimmäisenä Abel , Rountree, ja Turner vuonna 1913, ensimmäinen hemodialyysi ihmisellä oli Haas (28. helmikuuta 1924), ja Kolff kehitti keinotekoisen munuaisen kliinisesti hyödylliseksi laitteeksi vuosina 1943-1945. Tämä tutkimus osoitti, että elämä voi pidentyä munuaisten vajaatoiminta .
Willem Kolff rakensi ensimmäisenä toimivan dialysaattorin vuonna 1943. Ensimmäinen menestyksekkäästi hoidettu potilas oli 67-vuotias ureeminen kooma nainen, joka sai tajuntansa 11 tunnin hemodialyysin jälkeen Kolffin dialysaattorilla vuonna 1945. Sen luomisen aikaan Kolffin tavoitteena oli tukea elämää akuutista munuaisten vajaatoiminnasta toipumisen aikana. Toisen maailmansodan päätyttyä Kolff lahjoitti viisi tekemääsä dialysaattoria sairaaloille ympäri maailmaa, mukaan lukien Mount Sinai Hospital, New York . Kolff asetti joukon suunnitelmia hänen hemodialyysikoneessa George Thorn klo Peter Bent Brigham Hospital in Boston . Tämä johti Kolffin dialysaattorin seuraavan sukupolven, ruostumattomasta teräksestä valmistetun Kolff-Brigham-dialyysikoneen, valmistukseen.
McKellarin (1999) mukaan kanadalainen kirurgi Gordon Murray antoi merkittävän panoksen munuaishoitoihin kahden lääkärin, kemian perusopiskelijan ja tutkimushenkilöstön avustuksella. Murray työskenteli samanaikaisesti ja riippumattomasti Kolffin työstä. Murrayn työ johti ensimmäiseen menestykselliseen Pohjois-Amerikkaan vuosina 1945–46 rakennettuun keinotekoiseen munuaiseen, jota käytettiin menestyksekkäästi 26-vuotiaan naisen hoitoon ureemisesta koomasta Torontossa. Vähemmän raaka, kompakti, toisen sukupolven "Murray-Roschlau" -dialysaattori keksittiin vuosina 1952–53, jonka mallit varastivat saksalainen maahanmuuttaja Erwin Halstrup ja luovutti omansa ("Halstrup – Baumann-keinotekoinen munuainen") .
1950 -luvulle mennessä Willem Kolffin keksintö dialysaattorista käytettiin akuuttiin munuaisten vajaatoimintaan, mutta sitä ei pidetty elinkelpoisena hoitona potilaille, joilla oli vaiheen 5 krooninen munuaissairaus (CKD). Tuolloin lääkärit uskoivat, että potilaiden oli mahdotonta saada dialyysiä loputtomiin kahdesta syystä. Ensinnäkin he ajattelivat, ettei mikään ihmisen tekemä laite voisi korvata munuaisten toimintaa pitkällä aikavälillä. Lisäksi dialyysihoitoa sairastavalla potilaalla oli vaurioituneita laskimoita ja valtimoita, joten useiden hoitojen jälkeen oli vaikeaa löytää verisuonia potilaan vereen.
Alkuperäinen Kolffin munuainen ei ollut kliinisesti kovin hyödyllinen, koska se ei mahdollistanut ylimääräisen nesteen poistamista. Ruotsalainen professori Nils Alwall koteloi muokatun version tästä munuaisesta ruostumattomasta teräksestä valmistetun säiliön sisälle, johon voitiin kohdistaa alipaine, mikä sai aikaan ensimmäisen todella käytännöllisen hemodialyysin, joka tehtiin vuonna 1946 Lundin yliopistossa . Alwall oli myös epäilemättä dialyysi -arteriovenoosisen shuntin keksijä. Hän kertoi tästä ensimmäisen kerran vuonna 1948, jossa hän käytti tällaista arteriovenoosista shunttia kaneissa. Myöhemmin hän käytti tällaisia lasista valmistettuja shuntteja sekä säiliön koteloitua dialysaattoriaan hoitamaan 1500 munuaisten vajaatoimintaa sairastavaa potilasta vuosina 1946-1960, kuten raportoitiin Evianissa syyskuussa 1960 järjestetylle ensimmäiselle kansainväliselle nefrologiakongressille. nimitettiin äskettäin Lundin yliopiston nefrologian opettajaksi vuonna 1957. Myöhemmin hän teki yhteistyötä ruotsalaisen liikemies Holger Crafoordin kanssa ja perusti yhden tärkeimmistä dialyysilaitteita valmistavista yrityksistä Gambron . Stanley Shaldon on tarkastellut dialyysin varhaista historiaa.
Belding H.Scribner , joka työskenteli biomekaanisen insinööri Wayne Quintonin kanssa , muutti Alwallin käyttämiä lasisuntia tekemällä ne teflonista . Toinen tärkeä parannus oli liittää ne lyhyeen silikonielastomeeriputkeen. Tämä muodosti perustan niin kutsutulle Scribner-shuntille, jota ehkä paremmin kutsutaan Quinton-Scribner-shuntiksi. Hoidon jälkeen verenkiertoon pääsy pidettäisiin auki kytkemällä kaksi putkea kehon ulkopuolelle pienellä U-muotoisella teflonputkella, joka ohjaa verta valtimon putkesta takaisin laskimoon.
Vuonna 1962 Scribner aloitti maailman ensimmäisen avohoidon dialyysilaitoksen, Seattlen keinotekoisen munuaiskeskuksen, jonka nimi muutettiin myöhemmin Luoteis -munuaiskeskukseksi . Heti syntyi ongelma, kenelle dialyysihoito annettaisiin, koska kysyntä ylitti selvästi kuuden keskustassa olevan dialyysikoneen kapasiteetin. Scribner päätti, ettei hän tee päätöstä siitä, kuka saa dialyysihoitoa ja kuka ei. Sen sijaan valinnat tekisi anonyymi komitea, jota voitaisiin pitää yhtenä ensimmäisistä bioetiikan komiteoista.
Yksityiskohtainen historia onnistuneista ja epäonnistuneista dialyysiyrityksistä, mukaan lukien pioneerit, kuten Abel ja Roundtree, Haas ja Necheles, ovat tässä Kjellstrandin katsauksessa.
Katso myös
Viitteet
Ulkoiset linkit
- Munuaisesi ja miten ne toimivat - (amerikkalainen) National Institute of Diabetes and Digestive and Midney Diseases (NIDDK), NIH .
- Munuaisten vajaatoiminnan hoitomenetelmät - (Amerikan) National Institute of Diabetes and Digestive and Munic Diseases (NIDDK), NIH .
- Munuaisten vajaatoiminnan hoitomenetelmät: Hemodialyysi - (Amerikan) kansallinen munuaisten ja urologisten sairauksien tiedotuskeskus, NIH .