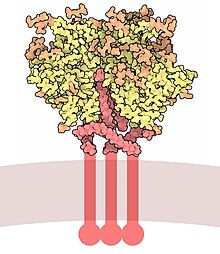
Kirjekuoren glykoproteiini GP120 - Envelope glycoprotein GP120
| Kirjekuoren glykoproteiini gp120 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Tunnisteet | |||||||||
| Symboli | GP120 | ||||||||
| Pfam | PF00516 | ||||||||
| InterPro | IPR000777 | ||||||||
| SCOP2 | 1gc1 / SCOPe / SUFFAM | ||||||||
| |||||||||
Kirjekuoren glykoproteiini GP120 (tai gp120 ) on glykoproteiini, joka paljastuu HIV -kirjekuoren pinnalle . Sen löysi professorit Tun-Hou Lee ja Myron "Max" Essex on Harvard School of Public Health 1988. 120 sen nimi tulee sen molekyylipaino on 120 kDa . Gp120 on välttämätön viruksen pääsemiseksi soluihin, koska sillä on tärkeä rooli sitoutumisessa tiettyihin solun pinnan reseptoreihin . Nämä reseptorit ovat DC-SIGN , heparaansulfaattiproteoglykaani ja erityinen vuorovaikutus CD4- reseptorin kanssa , erityisesti auttaja-T-soluissa . CD4-molekyyliin sitoutuva indusoi alkua kaskadin konformaatiomuutoksia gp120 ja gp41, joka johtaa fuusio viruksen membraanin isännän solukalvoon . Sitoutuminen CD4: een on pääasiassa sähköstaattista, vaikka van der Waalsin vuorovaikutuksia ja vetysidoksia on .
Gp120 on koodattu HIV -env -geenillä , joka on noin 2,5 kb pitkä ja koodaa noin 850 aminohappoa. Ensisijainen env tuote on proteiini gp160, joka saa pilkottu gp120: een (~ 480 aminohappoa) ja gp41 (~ 345 aminohappoa) on solulimakalvostossa , jonka solun proteaasi furiinin . Ydin gp120: n kiderakenne osoittaa organisaation, jolla on ulompi alue, sisäinen domeeni sen päähän nähden ja siltalevy . Gp120 on ankkuroitu viruksen kalvo , tai kirjekuoren, kautta ei-kovalenttisia sidoksia kanssa transmembraanisen glykoproteiinin , gp41 . Kolme gp120: tä ja gp41: ää yhdistyvät heterodimeerien trimeeriksi muodostaen kirjekuoren piikin, joka välittää kiinnittymisen isäntäsoluun ja pääsyn siihen.
Vaihtelevuus
Koska gp120: llä on tärkeä rooli HIV-1: n kyvyssä päästä CD4 + -soluihin, sen kehitys on erityisen kiinnostavaa. Monet neutraloivat vasta -aineet sitoutuvat kohtiin, jotka sijaitsevat gp120: n vaihtelevilla alueilla, joten näiden alueiden mutaatiot valitaan voimakkaasti. Env: n monimuotoisuuden on osoitettu lisääntyvän 1-2% vuodessa HIV-1-ryhmässä M, ja vaihtelevissa yksiköissä on havaittavissa nopeita muutoksia aminohapposekvenssin pituudessa. Gp120: n vaihtelun lisääntyminen johtaa merkittävästi kohonneisiin virusten replikaatiotasoihin, mikä osoittaa viruksen kunnon lisääntymistä yksilöillä, jotka ovat saaneet tartunnan eri HIV-1-muunnelmilla. Lisätutkimukset ovat osoittaneet, että potentiaalisten N-kytkettyjen glykosylaatiokohtien (PNGS) vaihtelu johtaa myös parantuneeseen viruksen kuntoon. PNGS: t mahdollistavat pitkäketjuisten hiilihydraattien sitoutumisen gp120: n suuren vaihtelun alueisiin, joten kirjoittajat olettavat, että PNGS: ien määrä env: ssä voi vaikuttaa viruksen kuntoon tarjoamalla enemmän tai vähemmän herkkyyttä neutraloiville vasta-aineille. Suurten hiilihydraattiketjujen läsnäolo gp120: stä voi peittää mahdolliset vasta -aineiden sitoutumiskohdat.
PNGS -lisäys- ja poistamismahdollisuuksien rajoja tutkitaan naiivisti kasvavien viruspopulaatioiden jälkeen jokaisen uuden infektion jälkeen. Vaikka lähettävä isäntä on kehittänyt neutraloivan vasta -ainevasteen gp120: lle, äskettäin tartunnan saaneelta isännältä puuttuu viruksen immuunitunnistus. Sekvenssitiedot osoittavat, että alkuviruksen muunnelmissa immunologisesti naiivissa isännässä on vähän glykosylaatiokohtia ja lyhyempiä altistuneita vaihtelevia silmukoita. Tämä voi helpottaa viruksen kykyä sitoa isäntäsolureseptoreita. Kun isännän immuunijärjestelmä kehittää vasta -aineita gp120: tä vastaan, immuunipaineet näyttävät valikoivan lisääntyneen glykosylaation, erityisesti gp120: n paljastetuissa vaihtelevissa silmukoissa. Näin ollen virus voi sietää env: n insertioita , jotka antavat enemmän PNGS: iä gp120: lle, koska suurempi glykaanitiheys edistää viruksen kykyä kiertää vasta -aineita ja edistää siten viruksen parempaa kuntoa. Kun otetaan huomioon, kuinka paljon PNGS -tiheys voisi teoriassa muuttua, PNGS -numerolla voi olla yläraja, koska se estää gp120 -taittumista, mutta jos PNGS -luku pienenee merkittävästi, virus havaitaan liian helposti neutraloivilla vasta -aineilla. Siksi vakauttava valintatasapaino on alhaisen ja korkean glykaanitiheyden välille todennäköisesti muodostunut. Pienempi määrä tilaa vieviä glykaaneja parantaa virusten replikaatiotehokkuutta ja suurempi määrä paljastetuissa silmukoissa auttaa isännän immuunivälin kiertämistä naamioimalla.
Gp120: n ja neutraloivien vasta -aineiden välinen suhde on esimerkki Red Queenin evoluutiodynamiikasta. Jatkuva evoluutiosopeutuminen on välttämätöntä, jotta viruksen vaippaproteiini ylläpitää kuntoa suhteessa isännän immuunineutraloivien vasta -aineiden jatkuviin evoluutiomuutoksiin ja päinvastoin muodostaen yhteiskehitysjärjestelmän.
Rokotteen kohde
Koska CD4 -reseptorin sitoutuminen on ilmeisin vaihe HIV -infektiossa, gp120 oli yksi HIV -rokotetutkimuksen ensimmäisistä kohteista . Gp120: een kohdistuvien HIV -rokotteiden kehittämistä on kuitenkin vaikeuttanut gp120: n kemialliset ja rakenteelliset ominaisuudet, jotka vaikeuttavat vasta -aineiden sitoutumista siihen. gp120 voidaan myös helposti irrottaa viruksen pinnalta ja ottaa T -solut kiinni, koska se on löysästi sitoutunut gp41: een. Gp120-glykoproteiinin konservoitunut alue, joka osallistuu gp120: n metastabiiliseen kiinnittymiseen CD4: ään, on tunnistettu ja invariantin alueen kohdentaminen on saavutettu laajalti neutraloivalla vasta-aineella, IgG1-b12: llä.
Science- julkaisussa julkaistu NIH- tutkimus raportoi kolmen vasta-aineen eristämisen, jotka neutraloivat 90% HIV-1- kannoista gp120: n CD4bs-alueella ja tarjoavat mahdollisesti terapeuttisen ja rokotestrategian. [1] Useimmat gp120: n CDbs-aluetta sitovat vasta-aineet eivät kuitenkaan neutraloi HIV: tä, ja harvoilla, kuten IgG1-b12: llä, on epätavallisia ominaisuuksia, kuten Fab-käsivarsien epäsymmetria tai niiden sijainti. Ellei gp120-pohjaista rokotetta voida suunnitella aikaansaamaan vasta-aineita, joilla on voimakkaasti neutraloivia viruksenvastaisia ominaisuuksia, on huolestuttavaa, että läpimurto-infektio, joka johtaa humoraaliseen suureen määrään ei-neutraloivia vasta-aineita, jotka kohdistuvat gp120: n CD4-sitoutumiskohtaan, liittyy nopeampaan taudin etenemiseen. AIDS.
Kilpailu
Gp120 -proteiini on välttämätön HIV: n sitoutumisen alussa kohdesoluunsa. Näin ollen kaikki, mikä sitoutuu gp120: een tai sen kohteisiin, voi fyysisesti estää gp120: n sitoutumisen soluun. Vain yksi tällainen aine, takia.Maravirokia , joka sitoo koreseptori CCR5 parhaillaan lisensoitu ja kliinisessä käytössä. Mikään aine, joka on kohdistettu gp120: n tärkeimpään solujen vuorovaikutuskumppaniin, CD4 , ei ole tällä hetkellä lisensoitu, koska häiriö tällaisen immuunijärjestelmän keskusmolekyylin kanssa voi aiheuttaa myrkyllisiä sivuvaikutuksia, kuten monoklonaalisen anti-CD4-vasta-aineen OKT4 . Itse gp120: n kohdistaminen on osoittautunut erittäin vaikeaksi sen vaihtelevuuden ja suojauksen vuoksi. Fostemsaviiri (BMS-663068) on pienimolekyylisen estäjän BMS-626529 metyylifosfaatti-aihiolääke, joka estää viruksen pääsyn sitoutumalla viruskuoreen gp120 ja häiritsemällä viruksen kiinnittymistä isäntä-CD4-reseptoriin.
HIV -dementia
HIV -virusproteiini gp120 indusoi hermosolujen apoptoosia estämällä furiinin ja kudoksen plasminogeeniaktivaattorin tasoja, entsyymejä, jotka ovat vastuussa pBDNF: n muuttamisesta mBDNF: ksi. gp120 indusoi mitokondrioiden kuoleman proteiineja, kuten kaspaaseja, jotka voivat vaikuttaa kuoleman reseptorin ylössäätelyyn, mikä johtaa hermosolujen apoptoosiin, gp120 indusoi oksidatiivista stressiä hermosoluissa, ja tiedetään myös aktivoivan STAT1 ja indusoivan interleukiinit IL-6 ja IL -8 eritystä hermosoluissa.
Katso myös
Viitteet
Lue lisää
- Ihmisen immuunikatoviruksen glykoproteiini 120
- Vashistha H, Husain M, Kumar D, Singhal PC (2009). "Putkisolujen HIV-1 gp120: n ilmentyminen indusoi kaspaasi 8: n aktivaation ja apoptoosin". Ren epäonnistui . 31 (4): 303–12. doi : 10.1080/08860220902780101 . PMID 19462280 . S2CID 205593494 .
Ulkoiset linkit
- https://web.archive.org/web/20060219135317/http://www.aidsmap.com/en/docs/4406022B-85D7-4A9B-B700-91336CBB6B18.asp
- http://www.mcld.co.uk/hiv/?q=gp120
- http://www.ebi.ac.uk/interpro/IEntry?ac=IPR000777
- Vashistha, H .; Husain, M .; Kumar, D .; Singhal, PC (2009). "Tubular Cell HIV-1 gp120 -ilmentymä indusoi kaspaasi 8 -aktivaation ja apoptoosin". Munuaisten vajaatoiminta . 31 (4): 303–312. doi : 10.1080/08860220902780101 . PMID 19462280 . S2CID 205593494 .