Perheen adenomatoottinen polypoosi - Familial adenomatous polyposis
| Perheen adenomatoottinen polypoosi | |
|---|---|
| Muut nimet | FAP |
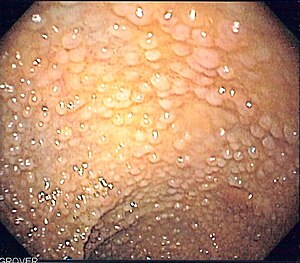 | |
| Endoskooppinen kuva sigmoidisesta paksusuolesta potilaalla, jolla on perinnöllinen adenomatoottinen polypoosi | |
| Erikoisuus | Gastroenterologia , onkologia |
| Komplikaatiot | Peräsuolen syöpä |
| Tavallinen alku | <35 vuotta |
| Kesto | Elinikäinen |
| Tyypit | Klassinen tai heikennetty |
| Syyt | APC -geenimutaatio |
| Diagnostinen menetelmä |
Kolonoskopia Geneettinen testaus |
| Differentiaalinen diagnoosi | Lynchin oireyhtymä , MUTYH: hen liittyvä polypoosi |
| Hoito | Kolonoskopia Polypectomy Ylempi endoskopia Kolektomia |
| Taajuus | 1/10 000 - 15000 |
Familiaalinen adenomatoottinen polypoosi ( FAP ) on autosomaalinen dominantti perinnöllinen sairaus, jossa lukuisia adenomatoottisia polyyppejä muodostavat pääasiassa epiteelissä ja paksusuolen . Vaikka nämä polyypit aloittaa hyvänlaatuinen , pahanlaatuisiksi osaksi paksusuolen syöpä ilmenee, kun ne jätetään hoitamatta. Tiedetään olevan kolme varianttia, FAP ja heikennetty FAP (alun perin perinnöllinen litteä adenoma-oireyhtymä ) johtuvat APC-geenivirheistä kromosomissa 5, kun taas autosomaalinen resessiivinen FAP (tai MUTYH-assosioitunut polypoosi ) johtuu kromosomin 1 MUTYH- geenin vikoista. Näistä kolmesta FAP on vakavin ja yleisin; vaikka kaikilla kolmella tuloksena olevat paksusuolen polyypit ja syövät rajoittuvat aluksi paksusuolen seinämään. Havaitseminen ja poistaminen ennen etäpesäkkeitä paksusuolen ulkopuolella voi vähentää merkittävästi ja monissa tapauksissa poistaa syövän leviämisen.
FAP: n perimmäisen syyn ymmärretään olevan geneettinen mutaatio - muutos kehon tuumorisuppressorigeeneissä, jotka estävät kasvainten kehittymisen. Muutoksen ansiosta lukuisat suolen seinämän solut voivat kehittyä mahdollisesti syöpäpolyypeiksi, kun ne yleensä saavuttavat elämänsä. väistämättä yksi tai useampi etenee lopulta ja aiheuttaa syöpää (7% riski 21 -vuotiaana, 87% 45 -vuotiaana ja 93% 50 -vuotiaana). Nämä geenimuutokset eivät laukaise syöpää, vaan pikemminkin vähentävät kehon kykyä estää solujen syöpää. Jopa geenimuutoksesta huolimatta voi vielä kestää jonkin aikaa ennen kuin solu todella kehittyy, mikä on seurauksena syövästä, ja geeni voi joissakin tapauksissa edelleen osittain toimia kasvainten hallitsemiseksi, joten FAP: n syöpä kehittyy vuosia ja on lähes aina aikuisten sairaus.
FAP: n toisessa muodossa, joka tunnetaan heikentyneenä perinnöllisenä adenomatoottisena polypoosina, on APC -geeni toiminnallinen, mutta hieman heikentynyt. Siksi se pystyy toimimaan normaalisti. Vaimennettu FAP sisältää edelleen suuren 70%: n syöpäriskin (arvioituna), mutta tyypillisesti siinä on paljon vähemmän polyyppejä (tyypillisesti 30) kuin satoja tai tuhansia tavallisesti FAP: ssa, ja se syntyy iässä, jolloin FAP ei yleensä ole enää pidetään todennäköisenä - tyypillisesti 40-70 -vuotiaita (keskimäärin 55 -vuotiaita) eikä tavallisia 30 -vuotiaita ylöspäin. Koska siinä on paljon vähemmän polyyppejä, hoitovaihtoehdot voivat olla erilaisia.
Kolmas muunnelma, autosomaalinen resessiivinen perinnöllinen adenomatoottinen polypoosi tai MUTYH: hen liittyvä polypoosi , on myös lievempi ja vaatii nimensä mukaisesti molempien vanhempien olevan ”kantajia” sairauden ilmentämiseksi.
Joissakin tapauksissa FAP voi ilmetä paksusuolessa tavallista korkeammalla (esimerkiksi nousevassa paksusuolessa tai pernan taivutuksen läheisyydessä tai vatsassa tai pohjukaissuolessa), jolloin niillä ei ole oireita, ennen kuin syöpä on läsnä ja pitkälle edennyt. APC -mutaatiot on yhdistetty tiettyihin muihin syöpiin, kuten kilpirauhassyöpään . Koska FAP: ää aiheuttava mutaatio on autosomaalisesti hallitseva, se voidaan periä suoraan joltakin vanhemmalta lapselle. Geneettinen verikokeen APC-geenin olemassa, että voi määrittää, onko se on läsnä, ja näin ollen voi ennustaa mahdollisuus FAP. Riskiryhmille (perhesiteiden tai geneettisen testauksen vuoksi) tarjotaan yleensä rutiininomaista suoliston seurantaa 1–3 vuoden välein koko elämän ajan, murrosiästä FAP: lle ja varhaisesta aikuisuudesta heikentyneiden muotojen osalta. Paksusuolen resektioleikkausta suositellaan, jos löytyy useita paksusuolen polyyppejä paksusuolen syövän varhaisen kuoleman riskin vuoksi. On olemassa kansainvälisiä polypoosirekistereitä, jotka seuraavat tunnettuja FAP- tai APC -geenivirheiden tapauksia tutkimusta ja kliinistä tarkoitusta varten. APC -mutaatiota esiintyy myös yleisesti paksusuolen karsinooman tapauksissa, mikä korostaa sen merkitystä tässä syöpämuodossa.
Merkit ja oireet
Varhaisesta murrosiästä alkaen potilaille, joilla on tämä tila, kehittyy vähitellen (ja useimmiten oireettomasti) satoja tuhansia paksusuolenpolyyppejä (ja joskus polyyppejä muualla ) - pieniä poikkeavuuksia suoliston pinnalla , erityisesti paksusuolessa, myös paksusuolessa tai peräsuoleen . Nämä voivat vuotaa verta, mikä johtaa vereen ulosteessa. Jos verta ei näy, potilaalle on edelleen mahdollista kehittyä anemia vähitellen kehittyvän raudanpuutteen vuoksi. Jos maligniteetti kehittyy, tämä voi esiintyä laihtuminen , suolen toiminnan muuttuminen, tai jopa etäpesäke , että maksaan tai muualle. FAP voi myös kehittyä "hiljaa" joillakin yksilöillä ja antaa vain vähän tai ei lainkaan merkkejä, ennen kuin siitä on kehittynyt pitkälle edennyt paksusuolen syöpä .
Koska perinnöllinen polypoosi kehittyy hyvin vähitellen vuosien varrella ja voi ilmetä myös heikentyneessä muodossa vieläkin vähitellen, FAP: n aiheuttamat polyypit voivat johtaa syövän kehittymiseen missä tahansa vaiheessa murrosiästä vanhuuteen.
Riippuen APC -geenin vian luonteesta ja siitä, onko se täysi tai heikennetty muoto, perinnöllinen polypoosi voi ilmetä polyyppeinä paksusuolessa tai pohjukaissuolikanavassa tai missä tahansa näiden yhdistelmästä. Siksi polyyppien puuttuminen esimerkiksi peräsuolessa ei ehkä yksinään riitä vahvistamaan polyyppien puuttumista. Saattaa olla tarpeen harkita ja tutkia silmämääräisesti muita mahdollisia suoliston osia. Tätä varten kolonoskopia on parempi kuin sigmoidoskopia , koska se havaitsee paremmin polyyppien yleisen oikeanpuoleisen sijainnin.
Perinnöllisen polypoosin geneettinen determinantti voi myös altistaa kantajia muille pahanlaatuisille kasvaimille, esimerkiksi pohjukaissuolen ja vatsan (erityisesti ampulaarisen adenokarsinooman). Muita merkkejä voivat viitata FAP on pigmentoituja leesioihin verkkokalvon ( "CHRPE-synnynnäinen liikakasvu verkkokalvon pigmenttiepiteelin"), leuka kystat, talikystat , ja osteomata (hyvänlaatuinen luu kasvaimia). Yhdistelmä polypoosin, osteoomat, fibromas ja talikystat kutsutaan Gardnerin oireyhtymä (tai ilman epänormaali arpeutuminen).
Genetiikka
Perheen adenomatoottisella polypoosilla voi olla erilaisia perintymalleja ja erilaisia geneettisiä syitä. Kun tämä tila johtuu APC -geenin mutaatioista , se perii autosomaalisen hallitsevan kuvion, mikä tarkoittaa, että yksi kopio muutetusta geenistä riittää aiheuttamaan häiriön. Pahanlaatuisuuden esiintyvyys näissä tapauksissa lähestyy 100%. Useimmissa tapauksissa sairastuneella on yksi vanhempi, jolla on sairaus.
APC -geenimutaation variantit
APC on tuumorisuppressorigeenin vastaa tuotannosta adenomatoottisen polypoosin coli (APC), suuri monitoiminen kasvain-estävä proteiini, joka toimii "portinvartija" kehittymisen estämiseksi kasvaimia. (APC säätelee β-kateniinia , proteiinia, jolla on ratkaiseva rooli solukommunikaatiossa, signaloinnissa, kasvussa ja kontrolloidussa tuhoutumisessa, mutta joka jää hallitsematta, aiheuttaa myös lukuisia syöpiä ). Vika APC -geenissä tarkoittaa, että APC ei ole niin tehokas kuin sen pitäisi olla, ja ajan myötä on todennäköistä, että jotkin solut, jotka olisi pitänyt kontrolloida APC: llä, eivät ole, vaan kehittävät edelleen ja muuttuvat syöväksi. Tuttuun polypoosiin ne ilmenevät yleensä polyypeinä - pieninä poikkeavuuksina suoliston pinnalla .
Vaikka polyypit ovat luonnostaan hyvänlaatuisia, kahden osuman hypoteesin ensimmäinen vaihe on jo tapahtunut: peritty APC-mutaatio. Usein jäljellä oleva "normaali" alleeli muuttuu tai poistuu, mikä nopeuttaa polyyppien muodostumista. Muut mutaatiot (esim. P53: ssa tai kRAS: ssa ) APC-mutatoituneille soluille johtavat paljon todennäköisemmin syöpään kuin ei-mutatoituneissa epiteelisoluissa .
APC -geenituotteen normaalia toimintaa tutkitaan edelleen; sitä on sekä solun ytimessä että kalvossa. APC: n kanoninen tuumorisuppressoritoiminto on β-kateniinin tukahduttaminen, mutta muut APC: n tuumorisuppressoritoiminnot voivat liittyä solujen tarttumiseen ja sytoskeleton- organisaatioon.
Mutaatio APC myös esiintyy yleisesti tapaus tapauksissa kolorektaalisyövän, korostaa sen merkitystä tässä muodossa syöpä.
MUTYH -geenimutaation variantit
MUTYH koodaa DNA: n korjaukseen entsyymi MYH glykosylaasi . Normaalin solutoiminnan aikana happi muuttaa joskus guaniinia , mikä saa sen muodostamaan pariliitoksen adeniinin kanssa sytosiinin sijaan. MYH -glykosylaasi korjaa nämä virheet emäksen poistamiskorjauksella siten, että mutaatiot eivät kerry DNA: han ja johtavat kasvaimen muodostumiseen. Kun MYH -glykosylaasi ei toimi oikein, DNA -virheitä voi kertyä kasvaimen synnyksen käynnistämiseksi, ja kliininen esitys on samanlainen kuin potilailla, joilla on APC -mutaatioita.
MUTYH -geenin mutaatiot periytyvät autosomaalisesti resessiivisessä mallissa, mikä tarkoittaa, että kaksi geenikopiota on muutettava, jotta häiriö vaikuttaa henkilöön. Useimmiten autosomaalisen taantumishäiriön omaavan lapsen vanhemmat eivät vaikuta, mutta he ovat yhden kopion muutetun geenin kantajia.
Eläinmallit
" Apc Min " -hiirimalli kuvattiin vuonna 1990 ja siinä on Apc -alleeli, jonka pysäytyskodoni on kohdassa 850. Tämän mutaation heterotsygoottisuus johtaa täysin läpäisevään fenotyyppiin useimmissa geneettisissä taustoissa, ja herkällä taustalla oleville hiirille kehittyy yli 100 kasvainta. suolistossa. Sitoutumattomat geenit muuttavat suolikasvainten määrää ja sijaintia. Sittemmin on ilmestynyt monia muita malleja, mukaan lukien heikennetty FAP-malli (1638N-malli) ja useita ehdollisia mutantteja, jotka mahdollistavat geenitoiminnon kudosspesifisen tai ajallisen ablaation. Katso lisätietoja kolorektaalisen ja suolistosyövän hiirimalleista .
Vuonna 2007 "ApcPirc" -rotamalli eristettiin pysäytyskodonilla asemassa 1137. Toisin kuin hiirimallit, joissa> 90% kasvaimista muodostuu ohutsuolessa, Pirc -rotta muodostaa kasvaimia ensisijaisesti (> 60%) paksusuolen, samanlainen kuin ihmisen kliininen esitys.
Diagnoosi

FAP -diagnoosin tekeminen ennen paksusuolisyövän kehittymistä on tärkeää paitsi yksilölle myös muille perheenjäsenille, joita tämä saattaa vaikuttaa. On olemassa kaksi diagnostista menetelmää:
- Kolonoskopia on tavanomainen diagnostinen testi, koska se suosii polyyppien yleistä oikeanpuoleista sijaintia paremmin kuin sigmoidoskopia, jos mutaatio on heikentynyt FAP, ja se voi vahvistaa tai sallia (a) todellisen kliinisen esityksen ja mahdolliset muutokset '' riskiryhmässä '' oleva henkilö, (b) polyyppien määrän määrittäminen koko paksusuolessa, (c) histologinen diagnoosi (solu-/syöpätyypin havaitseminen) ja (d) jos polyypit ovat olemassa, se voi ehdottaa, onko avohoidon poistaminen (poistaminen) elinkelpoista vai leikkaus on suositeltavaa. Barium -peräruiskeita ja virtuaalista kolonoskopiaa (lääketieteellisen kuvantamisen muoto) voidaan käyttää myös FAP -diagnoosin ehdottamiseen.
- Geneettinen testaus antaa lopullisen diagnoosin 95 prosentissa tapauksista; geneettistä neuvontaa tarvitaan yleensä perheissä, joissa FAP on diagnosoitu. Testaus voi myös auttaa rajatapausten diagnosoinnissa perheissä, jotka muutoin tunnetaan p34.3 ja p32.1 (1p34.3 – p32.1). Testaus voi osoittaa vain, onko henkilö altis FAP: lle tai sulje sen pois (eli onko hän perinyt viallisen APC -geenin vai ei). Se ei voi määrittää potilaan todellista tilaa; tämä voidaan todeta vain suoralla fyysisellä tutkimuksella.
NCBI toteaa, että lääkäreiden on varmistettava, että he ymmärtävät minkä tahansa vuoden 1997 jälkeen tehdyn geneettisen testin "riskit, edut ja rajoitukset" "lähes kolmannekselle FAP: sta arvioiduista henkilöistä, lääkäri tulkitsi testitulokset väärin".
Kun FAP -diagnoosi on tehty, kolonoskooppinen tarkka seuranta polypectomialla on tarpeen.
Prenataalinen testaus on mahdollista, jos sairauden aiheuttava mutaatio havaitaan sairastuneessa perheenjäsenessä; synnytystä edeltävä testaus tyypillisesti aikuisilla esiintyville häiriöille on kuitenkin harvinaista ja vaatii huolellista geneettistä neuvontaa .
Vatsan ultraääni ja maksan toimintaa arvioivat verikokeet suoritetaan usein metastaasien poissulkemiseksi maksassa.
Hallinto

Perinnöllisen polypoosin kehittymistavan vuoksi on mahdollista saada geneettinen tila ja siksi olla vaarassa, mutta ei toistaiseksi polyyppejä tai ongelmia. Siksi yksilö voidaan diagnosoida "vaarassa" FAP: iin ja vaatia rutiininomaista seurantaa, mutta hänellä ei (vielä) ole todellista FAP: ta (eli hänellä on viallinen geeni, mutta toistaiseksi ei näytä olevan mitään todellista lääketieteellistä ongelmaa tämän seurauksena ). Kliininen hoito voi kattaa useita alueita:
- Niiden yksilöiden tunnistaminen, jotka voivat olla FAP -vaarassa: yleensä perheen sairaushistorian tai geneettisen testauksen perusteella
- Diagnoosi (vahvistaa, onko niillä FAP) - tämä voidaan tehdä joko geneettisellä testillä, joka on lopullinen, tai tarkistamalla silmämääräisesti itse suolisto.
- On tärkeää huomata, että silmämääräinen tarkastus tai seuranta ei voi '' selvittää '' riskiä. Se voi vain sanoa, mikä heidän tilansa on tuolloin. Jos henkilölle kehittyy jossain elämänsä vaiheessa lukuisia polyyppejä, tämä viittaa FAP -diagnoosiin. (Polyyppien puuttuminen ei "puhdista" ihmistä, koska polyypit voivat kehittyä myöhemmin elämässä; myös muutama polyyppi ajan mittaan ei ole niin harvinaista ihmisillä, joilla ei ole FAP: ta. Kuitenkin huomattava määrä tai runsaasti polyyppejä yleensä viittaavat FAP -diagnoosi ja histopatologia sen määrittämiseksi, ovatko polyypit syöpää.)
- Seulonta-/seurantaohjelmiin kuuluu suoliston silmämääräinen tarkastus sen terveen tilan tarkistamiseksi. Se suoritetaan rutiininomaisesti muutaman vuoden välein, jos on syytä huoleen, jos joko (a) geneettinen testi on vahvistanut riskin tai (b) geneettistä testiä ei ole jostain syystä tehty, joten todellinen riski on tuntematon. Seulonnan ja seurannan avulla polypoosi voidaan havaita visuaalisesti ennen kuin siitä voi tulla hengenvaarallinen.
- Hoitoon, tyypillisesti jonkinlaiseen leikkaukseen, liittyy, jos polypoosi on johtanut suureen määrään polyyppejä tai merkittävä syöpäriski tai todellinen syöpä.
Perhehistoria
NCBI toteaa, että "vaikka useimmilla yksilöillä, joilla on diagnosoitu APC: hen liittyvä polypoosisairaus, on sairastunut vanhempi, perhehistoria saattaa vaikuttaa negatiiviselta, koska häiriötä ei tunnisteta perheenjäsenissä, vanhemman varhainen kuolema ennen oireiden alkamista, tai taudin alkaminen myöhään sairastuneella vanhemmalla. " Lisäksi noin 20% tapauksista on de novo -mutaatio, ja niistä, joilla on ilmeinen de novo APC -mutaatio (eli ei tiedossa olevaa sukuhistoriaa), 20%: lla on somaattinen mosaiikki . Oireettomia yksilöitä (ja siten oireettomia perheenjäseniä) tiedetään myös olevan olemassa.
Seuranta
Seurantaan kuuluu avohoidon kolonoskopia ja toisinaan mahalaukun yläosan ruokatorven ja ruokatorven duodoskopia (EGD, joka etsii ennenaikaista maha- tai pohjukaissyöpää ), tyypillisesti kerran 1-3 vuodessa, ja/tai geneettinen verikoe herkkyyden lopulliseksi vahvistamiseksi tai kiistämiseksi. Pieni polyyppien määrä voidaan usein leikattiin (poistettu) menettelyn aikana jos löytyy, mutta jos on enemmän vakavia merkkejä tai numeroita sairaalapotilaiden leikkaus voi olla tarpeen.
NCBI toteaa, että kun yksilö todetaan sairastavan FAP: ää tai FAP: iin johtavia mutaatioita: "On asianmukaista arvioida sairaan yksilön vanhemmat (a) APC: n molekyyligeneettisellä testauksella, jos tautia aiheuttava mutaatio tunnetaan proband [sairaus ensin tunnistettu henkilö] tai (b) APC: hen liittyvien polypoositilojen kliinisiin ilmenemismuotoihin ".
Hoito
FAP -hoito riippuu genotyypistä . Useimmat ihmiset, joilla on APC-mutaatio, kehittävät paksusuolen syövän 40-vuotiaana, vaikka harvinaisempi heikennetty versio ilmenee tyypillisesti myöhemmin elämässä (40–70). Näin ollen monissa tapauksissa ehkäisevää leikkausta voidaan suositella ennen 25 vuoden ikää tai havaitsemisen jälkeen, jos sitä seurataan aktiivisesti. On olemassa useita kirurgisia vaihtoehtoja, jotka sisältävät joko paksusuolen tai sekä paksusuolen että peräsuolen poistamisen.
- Peräsuolen mukana: peräsuolen ja osa tai koko paksusuolen poistetaan. Potilas saattaa tarvita ileostomiaa (pysyvä stoma, jossa uloste menee pussiin vatsassa) tai ileo-anaalipussin rekonstruktio. Päätös peräsuolen poistamisesta riippuu peräsuolen polyyppien määrästä ja suvusta. Jos peräsuolessa on vähän polyyppejä, kaksoispiste poistetaan osittain tai kokonaan ja ohutsuoli (ileum) voidaan yhdistää suoraan peräsuoleen ( ileorektaalinen anastomoosi ).
- Peräsuolesta ei ole kyse: osa paksusuolesta, joka ilmentää polyyppejä, voidaan poistaa ja päät liittää uudelleen ( osittainen kollektomia ), leikkaus, jolla on huomattava paranemisaika, mutta joka jättää elämänlaadun suurelta osin ennalleen.
Ennaltaehkäisevä kollektomia on tarkoitettu, jos läsnä on yli sata polyyppiä, jos on vakavasti dysplastisia polyyppejä tai jos läsnä on useita yli 1 cm: n polyyppejä.
FAP: n kahden lievemmän muodon hoito voi olla olennaisesti erilainen kuin tavallisempi variantti, koska polyyppien määrä on paljon pienempi, mikä mahdollistaa enemmän vaihtoehtoja.
Erilaisia lääkkeitä tutkitaan polyyppien pahanlaatuisen rappeutumisen hidastamiseksi, etenkin ei-steroidisia tulehduskipulääkkeitä (NSAID). Tulehduskipulääkkeiden on osoitettu vähentävän merkittävästi polyyppien määrää, mutta eivät yleensä muuta hoitoa, koska seurattavia ja endoskooppisesti hoidettavia polyyppejä on edelleen liian paljon. Lääkettä eflornitiinia , ornitiinidekarboksylaasin estäjää, jota tyypillisesti käytetään trypanosomiaasin hoitoon , tutkitaan mahdollisena ennaltaehkäisevänä lääkkeenä yhdessä NSAID -selekoksibin kanssa FAP: n hoitoon. Toinen tutkittava aine on sulindaakki , jota käytetään myös yhdessä tulehduskipulääkkeiden kanssa.
Ennuste
Ennen kolorektaalisyövän pitkälle edenneitä vaiheita, polyypit rajoittuvat suoliston sisäseinään ja paksuuteen eivätkä levitä tai levitä etäpesäkkeitä. Jos FAP havaitaan ja sitä hallitaan joko syöpää edeltävässä vaiheessa tai kun syöpäpolyyppejä on edelleen suolistossa, leikkauksella onnistutaan erittäin hyvin ehkäisemään tai poistamaan syöpä ilman toistumista, koska syöpää aiheuttavat kohdat fyysisesti poistetaan toto jonka leikkauksen.
Jos leikkauksen jälkeen on suoritettu osittainen kollektomia , jäljellä olevan paksusuolen kolonoskooppinen seuranta on tarpeen, koska yksilöllä on edelleen paksusuolensyövän riski. Jos näin kuitenkin tapahtuisi, se olisi uusi tapaus polyypeistä, jotka kehittyvät uudelleen paksusuolen poistamattomassa osassa leikkauksen jälkeen, eikä alkuperäisen leikkauksen poistaman syövän paluu tai etäpesäke .
Epidemiologia
Mutaation ilmaantuvuus on 1/10 000 ja 1-15000 syntymää. 35 -vuotiaana 95%: lla yksilöistä, joilla on FAP (> 100 adenoomaa), on polyyppejä. Ilman kolektomiaa paksusuolen syöpä on käytännössä väistämätön. Paksusuolen syövän keski -ikä hoitamattomilla henkilöillä on 39 vuotta (vaihteluväli 34–43 vuotta).
Vaimennettu FAP syntyy, kun APC on viallinen, mutta silti jonkin verran toimiva. Tämän seurauksena se säilyttää osan kyvystään tukahduttaa polyyppejä. Siksi heikentynyt FAP ilmenee paksusuolen syöpänä epätavallisen myöhään (ikä 40–70, keskiarvo = 55) ja tyypillisesti vain vähän tai ainakin paljon vähemmän polyyppejä (tyypillisesti 30) kuin FAP: n tavanomaisempi versio, iässä, jolloin FAP tavanomaisen FAP -epidemiologian mukaan sitä ei enää pidetä suurena todennäköisyytenä tai riskinä.
FAP -varianttien vertailu
Tässä taulukossa verrataan FAP: n eri alatyyppejä:
| Tuote | FAP | Vaimennettu FAP | MUTYH Associated FAP |
| Gene | APC | APC | MUTYH |
| Tyypillinen polyp -ilmentymä | Satoja / tuhansia | Alle 100 (0–470, tyyp. 30), joskus litteä eikä polypoidinen morfologia, ja enemmän pernan taipumiseen nähden. 120 yksilöä koskevassa tutkimuksessa 37%: lla (N = 44) oli <10 polyyppiä; 3 näistä 44: stä sairastui peräsuolen syöpään]. Mahalaukun fundic -polyyppejä ja pohjukaissuolen adenoomia nähdään myös. Näin ollen, polyypit ja syöpiä voi ilmetä, että ylempi osa paksu- tai ylemmän maha-suolikanavan kuin tavanomainen sijainnit | ? |
| Tyypilliset diagnostiset perusteet | (a) yli 100 polyyppiä ja alle 40 -vuotiaat, TAI (b) polyypit ja FAP sukulaisella | Ei vielä ratkaistu. a) suvussa ei ole esiintynyt 100+ polyyppiä ennen 30 -vuotiaita, PLUS YKSI 10–99 polyyppiä / 100+ polyyppiä ja yli 35–40 -vuotiaita / kolorektaalisyöpä ennen 60 -vuotiaita ja sukulaisia, joilla on useita adenomatoottisia polyyppejä, TAI (b) sukuhistoria 10-99 adenomaa diagnosoitu 30 vuoden iän jälkeen | ? |
| Ikä, jolloin polyypit ilmenevät | 7–36 (tyyppi 16), joka kasvaa nopeasti sen jälkeen | ? | ? |
| Paksusuolen syövän riski ( läpäisy ) ja ikä, jos sitä ei hoideta | "väistämätön .. lähes 100%": 7% 21 -vuotiaana, 87% 45 -vuotiaana, 93% 50 -vuotiaana. Tyypilliset iät: 34–43 (keskim. 39) | "Alempi .. vähemmän tunnettu .. arviolta 70% 80 -vuotiaana". Sovaria toteaa, että vuonna 1998 "keski -ikä CRC -diagnoosin yhteydessä on ~ 58 vuotta" | ? |
| Vaihtelevuus | Perheiden väliset ja perheiden väliset fenotyyppiset vaihtelut ovat yleisiä | Katso FAP | ? |
| Mahdollisia ei-kaksoispisteitä | "mahalaukun pohjan ja pohjukaissuolen polyypit, osteomat, hampaiden epämuodostumat, verkkokalvon pigmenttiepiteelin (CHRPE) synnynnäinen hypertrofia, pehmytkudoskasvaimet, desmoidikasvaimet ja niihin liittyvät syövät" | Mitä tulee FAP: ään, mutta "CHRPE- ja desmoidikasvaimet ovat harvinaisia", ja myös kilpirauhassyöpä lisätään. | ? |
| Muut elinikäiset riskit | "Ohutsuolen [pohjukaissuolen tai periampullan] karsinooma 4–12%[distaalinen pohjukaissuoleen] Harvinainen; Haiman adenokarsinooma ~ 1%; Papillaarinen kilpirauhaskarsinooma 1–2%; keskushermosto [tyypin medulloblastooma] <1%; Maksan hepatoblastooma 1,6%; Sappi kanavat adenokarsinooma Matala mutta lisääntynyt; Mahan adenokarsinooma <1% länsimaisissa kulttuureissa. " | ? | ? |
| Perintö | "peritty autosomaalisesti hallitsevalla tavalla. Noin 75% -80%: lla yksilöistä, joilla on APC: hen liittyvä polypoosi, on sairastunut vanhempi. Vaurioituneen yksilön jälkeläisillä on 50% riski periä sairaus aiheuttava mutaatio" | Sama kuin FAP | Erilainen - taantuma (vaatii 2 vanhempaa kantajaksi) |
| Geneettinen yleiskatsaus ja geneettinen havaitseminen | "Kaikkien APC-eksonien ja introni-eksonien rajojen täydellinen geenisekvensointi näyttää olevan tarkin saatavilla oleva kliininen testi. Useimmat APC-mutaatiot ovat hölynpölyä tai kehyksensiirtymämutaatioita, jotka aiheuttavat APC-proteiinin ennenaikaisen katkaisun. APC-mutaation havaitsemisen todennäköisyys on erittäin suuri." riippuen paksusuolen polypoosin vakavuudesta ja sukututkimuksesta. APC-lokus; näin ollen niitä voidaan käyttää yli 98%: n tarkkuudella yli 95%: ssa perheistä, joilla on APC: hen liittyvä polypoosi. yksilöllä on de novo -geenimutaatio eikä hänellä ole jälkeläisiä. pitäisi harkita. " | "Alle 30%: lla yksilöistä, joilla on heikentynyt fenotyyppi, odotetaan olevan tunnistettavissa oleva APC -mutaatio" (katso myös tiedot FAP -kohdasta) | ? |
| Genotyyppi-fenotyyppi [Perusedellytys] | Yleisin APC -mutaatio on kodonissa 1309 ja johtaa suureen määrään polyyppejä varhaisessa iässä (~ 20). Vahva polypoosi (keskim. = 5000) raportoitu mutaatioilla kodoneissa 1250–1464. Suurin osa APC: n osittaisista ja kokonaisista deleetioista liittyy 100–2000 paksusuolen adenoomiin, vaikka heikennettyä FAP: a on havaittu. Näytteen tyypillinen alkamisikä: kodonin 168 ja 1580 välillä (lukuun ottamatta 1309) = 30 vuotta, 5 'kodonia 168 ja 3' kodonia 1580 = 52 vuotta. | Vaimennettu FAP liittyy geenin 5' -osan (kodonit 1–177), eksonin 9 ja geenin distaalisen 3' -pään mutaatioihin (tyypillisesti katkaisemiseen); kromosomin 5q22 interstitiaaliset deleetiot, jotka sisältävät APC: n; osittaiset ja koko geenin poistot; ja somaattinen mosaiikki APC -mutaatioille, jotka yleensä liittyvät klassiseen FAP: ään. Sovaria toteaa, että heikentynyt FAP johtuu "mutaatioista APC -geenin kolmella eri alueella - 5' -pää alueella, joka ulottuu eksoneihin 4 ja 5, eksoniin 9 ja äärimmäiseen 3' -päähän. Fenotyyppinen ilmentyminen näissä kolmessa sukulaisryhmässä on vaihteleva, mutta on ehdottomasti lievempi kuin klassisessa FAP: ssä "ja että peräsuolen polyypit ovat harvinaisia heikennetyssä FAP: ssa, mutta ei ole vielä vahvistettu, tarkoittaako tämä myös sitä, että myös peräsuolen syövän riski on pienempi. | ? |
| Genotyyppi-fenotyyppi [Muut paksusuolen ulkopuoliset olosuhteet] | Näkyvät ekstrakoloniset ilmenemismuodot korreloivat usein (tosin ei täysin) distaalisempien APC -mutaatioiden kanssa. FAP: n ja ekstrakolonisten oireiden yleistutkimus osoitti : kodonien 1395–1493 mutaatioissa on huomattavasti suurempi desmoidikasvainten, osteoomien ja epidermoidisten kystien määrä kuin niillä, joilla on mutaatioita kodonissa 177–452; kodonien 1395–1493 mutaatioilla on huomattavasti suurempi desmoidikasvainten ja osteoomien määrä kuin niillä, joilla on mutaatioita kodonissa 457–1309; yksikään henkilö, jolla oli mutaatioita kodonissa 177–452, ei kehittänyt osteoomia tai periampulaarisia syöpiä; vain yksilöille, joilla oli mutaatioita kodonissa 457–1309, kehittyi hepatoblastooma ja/tai aivokasvaimia. Pohjukaissuolen adenoomia : nelinkertainen riski, joilla on mutaatioita kodonien välillä 976 ja 1067. desmoidisairaus kasvaimet : mutaatiot 3' kodonin 1399 liittyivät desmoidisairaus kasvaimen kehityksen kisuhteeseen 4,37; desmoidikasvaimet 20 prosentilla yksilöistä, joilla on mutaatioita 5 'kodoniin 1444, 49 prosenttiin yksilöistä, joilla on mutaatioita 3' kodoniin 1444, ja 61 prosenttiin yksilöistä, joilla on mutaatioita kodoneissa 1445–1580; useilla perheillä, joilla oli vaikeita desmoidikasvaimia, oli mutaatioita äärimmäisessä 3' -päässä; desmoidikasvainten johdonmukainen yhdistäminen koodonin 1444 distaalisiin mutaatioihin. CHRPE liittyy: mutaatioihin kodonien 311 ja 1444 välillä; koko APC -geenin deleetioita. Kilpirauhassyöpä ja FAP : 24 yksilöllä suurin osa tunnistetuista mutaatioista oli 5' -koodoniin 1220 [Cetta et ai. 2000]; Yhdeksällä 12 henkilöstä oli APC -mutaatioita, jotka tunnistettiin proksimaalisesti mutaatioryhmäalueelle (kodonit 1286–1513). Kirjallisuuden yleiskatsaus (elokuuhun 2006) : paljasti 89 submikroskooppista APC-deleetiota (42 osittaista ja 47 koko geenin deleetiota). Ekstrakolonisia löydöksiä havaittiin 36%: ssa tapauksista, eikä niissä ollut merkittäviä eroja niissä, joilla oli osittainen tai koko geenin deleetio. | ? | ? |
| Levinneisyys | "2,29-3,2 100 000 yksilöä kohden. APC: hen liittyvien polypoositilojen osuus historiallisesti oli noin 0,5% kaikista kolorektaalisyövistä; tämä luku laskee, kun riskialttiimpia perheenjäseniä hoidetaan onnistuneesti hoidon jälkeen varhaisen polyyppien havaitsemisen ja ennaltaehkäisevän kollektomian jälkeen." | "Todennäköisesti alidiagnosoitu, koska paksusuolen polyyppien määrä on pienempi ja paksusuolen syövän riski pienempi kuin klassisessa FAP: ssä" | ? |
| Ilmentymien hoito | Klassinen FAP: "Kolektomiaa suositellaan adenoomien ilmaantumisen jälkeen; kollektomia voi viivästyä adenomatoottisten polyyppien koon ja lukumäärän mukaan. Kolektomiaa suositellaan yleensä, kun on kehittynyt yli 20 tai 30 adenomaa tai useita adenoomia, joilla on kehittynyt histologia" | "Kolektomia voi olla tarpeen, mutta noin kolmanneksella yksilöistä paksusuolen polyyppien määrä on niin rajallinen, että valvonta säännöllisellä kolonoskooppisella polypektomialla riittää" | ? |
| Valvonta (seuranta), kun riski on määritetty | "Sigmoidoskopia tai kolonoskopia 1–2 vuoden välein, alkaen 10–12 -vuotiaasta; kolonoskopia, kun polyypit on havaittu; vuosittainen kolonoskopia, jos kollektomia viivästyy yli vuoden kuluttua polyyppien ilmaantumisesta (ikä 10–20 vuotta, lievempiä oireita, Esophagogastroduodenoscopy (EGD) 25 vuoden iässä tai ennen kollektomiaa ja toistetaan 1–3 vuoden välein; joissakin tapauksissa endoskooppinen retrogradinen kolangiopankreatografia (ERCP) yhteisen sappitiehyen adenoomien arvioimiseksi; suolen kuvantaminen, kun pohjukaissuolen adenoomia havaitaan tai ennen kollektomiaa, toistetaan 1-3 vuoden välein löydöksistä riippuen; hepatoblastooman seulonta (optimaalinen aikaväli tuntematon, yksi paperi suosittelee "vähintään joka kolmas kuukausi"); vuosittainen fyysinen tutkimus, mukaan lukien suoliston ulkopuolinen arviointi ilmenemismuotoja ja kilpirauhan palpataatiota ottaen huomioon ultraäänitutkimus ja ohuen neulan imeminen, jos kilpirauhasen kyhmyjä on läsnä " | "Kolonoskopia kahden tai kolmen vuoden välein, 18-20 -vuotiaana; esophagogastroduodenoscopy (EGD), joka alkaa 25 -vuotiaana tai ennen kollektomiaa ja toistetaan 1-3 vuoden välein; joissakin tapauksissa endoskooppinen retrogradinen kolangiopankreatografia (ERCP) voi olla tarpeen yleisen sappitiehyen adenoomien arviointi; vuosittainen fyysinen tutkimus ja kilpirauhasen tunnistus, ottaen huomioon ultraäänitutkimus ja ohuen neulan imeminen, jos kilpirauhasen kyhmyjä on läsnä. kehittynyt histologia ovat kehittyneet. " Sovaria toteaa vuonna 1998, että "kolonoskopiaa, toisin kuin sigmoidoskopiaa, tulisi suositella endoskooppiseen seurantaan paksusuolen peräsuolen adenoomien oikeanpuoleisen sijainnin vuoksi; UGI-endoskooppinen valvonta on perusteltua, kun halutaan havaita mahalaukun tai pohjukaissuolen kasvaimia. [heikennetty FAP] voi vaatia täydellistä kollektomiaa ileo-peräsuolen anastomoosin kanssa vain silloin, kun ennaltaehkäisevää kolektomiaa suositellaan. " | ? |
| Päätös seurata | "Varhainen tunnustaminen voi mahdollistaa oikea-aikaisen toimenpiteen ja paremman lopputuloksen; näin ollen oireettomien, riskialttiiden lasten seuranta varhaisten ilmenemismuotojen varalta on tarkoituksenmukaista; geneettinen testaus on kustannustehokkaampaa kuin sigmoidoskopia sen määrittämiseksi, ketkä perheestä kärsivät; APC-potilaat -siihen liittyvät polypoositilat, jotka johtuvat sairastuneesta sukulaisesta, ovat merkittävästi pidempi elinajanodote kuin niillä yksilöillä, jotka on diagnosoitu oireiden perusteella. geneettistä testausta tarjotaan yleensä lapsille, joilla on klassisen FAP -riskin riski kymmenen vuoden iässä. Geneettinen testaus syntymähetkellä voi myös olla perusteltua, koska jotkut vanhemmat ja lastenlääkärit voivat harkita hepatoblastooman seulontaa lapsuudesta 5 vuoden ikään kärsineillä jälkeläisillä. optimaalinen ikä seulonnan aloittamiselle. " | Katso FAP. Myös "Paksusuolen seulonta niille, joilla on heikentynyt FAP, alkaa 18-20 -vuotiaana; näin ollen molekyyligeneettistä testausta tulisi tarjota niille, jotka ovat vaarassa saada heikennetty FAP noin 18 -vuotiaana." | ? |
| Perinnöllisyys ja vahvistetun diagnoosin vaikutukset muihin lähisukulaisiin | APC: hen liittyvät polypoositilat periytyvät autosomaalisesti hallitsevalla tavalla. Noin 20–25%: lla on muuttunut geeni de novo -geenimutaation seurauksena. Vähän tai ei lainkaan todisteita äidin/isän puolueellisuudesta tai vaikutuksesta, joka liittyy edistyneeseen isän ikään de novo -mutaatioissa. Sisaruksilla on klassinen 50%: n riski jakaa sairaus, jos se on perinnöllinen eikä de novo, ja "pieni" mutta hieman suurempi riski kuin yleinen, jos de novo , joten geneettistä testausta olisi tarjottava. Jokaisella jälkeläisellä on 50% mahdollisuus periä. Muut perheenjäsenet ovat vaarassa, jos heidän vanhempansa jakavat saman mutaation. Sikiön mosaiikki on dokumentoitu oireettomissa tapauksissa. Prenataalinen testaus on mahdollista sikiön uutetun DNA: n kautta . | Katso FAP | ? |
Polyposis -rekisterit
FAP: n geneettisen luonteen vuoksi polyposisrekistereitä on kehitetty ympäri maailmaa. Näiden rekisterien tarkoituksena on lisätä tietämystä FAP: n tarttuvuudesta, mutta myös dokumentoida, seurata ja ilmoittaa tartunnan saaneiden henkilöiden perheenjäsenille. Eräs tutkimus on osoittanut, että käyttö rekisterin ilmoittamaan perheenjäsenet (kutsuntatilaisuudessa) vähensi kuolleisuutta verrattuna nervosaa . Pyhän Markuksen polypoosin rekisterissä on vanhin maailmassa, alkoi vuonna 1924, ja monet muut polypoosin rekistereitä nykyään.
Katso myös
- Peräsuolen syöpä
- Polyp (lääke)
- Adenoma
- Adenomatoottiset polyypit
- Peräsuolen polyyppi
- Geneettinen testaus
Viitteet
Lue lisää
- Jasperson, Kory W .; Patel, Swati G .; Ahnen, Dennis J. (2. helmikuuta 2017). "APC: hen liittyvät polyposisolut" . Julkaisussa Adam MP; Ardinger HH; Pagon RA; Wallace SE (toim.). GeneReviews . Seattle WA: Washingtonin yliopisto. PMID 20301519 . NBK1345. - täydellinen kliininen yhteenveto FAP: sta ja heikennetystä FAP: sta, mukaan lukien elinikäiset riskit, epidemiologia jne.
- Familiaalinen adenomatosis klo NLM Genetics Home Reference
- Perheen adenomatoottinen polypoosi - eMedicine Gastroenterology
- Paksusuolen, polypoosin oireyhtymät
- National Cancer Institute: Genetics of Colorectal Cancer -tietojen yhteenveto
Ulkoiset linkit
| Luokitus | |
|---|---|
| Ulkoiset resurssit |

