Kasvaimen heterogeenisyys - Tumour heterogeneity
Kasvaimen heterogeenisyys kuvaa havaintoa, jonka mukaan eri kasvainsoluilla voi olla erilaisia morfologisia ja fenotyyppisiä profiileja, mukaan lukien solujen morfologia, geeniekspressio, aineenvaihdunta, liikkuvuus, lisääntyminen ja etäpesäke. Tämä ilmiö esiintyy sekä kasvainten välillä (kasvainten välinen heterogeenisyys) että kasvainten sisällä (kasvainten sisäinen heterogeenisyys). Minimaalinen kasvainsisäisen heterogeenisyyden taso on yksinkertainen seuraus DNA: n replikaation epätäydellisyydestä : aina, kun solu (normaali tai syöpä) jakautuu, saadaan muutamia mutaatioita -mikä johtaa syöpäsolujen monipuoliseen populaatioon. Heterogeenisyys syöpäsolujen tuo merkittäviä haasteita suunniteltaessa tehokkaita hoitostrategioita. Tutkimus heterogeenisyyden ymmärtämisestä ja luonnehtimisesta voi kuitenkin auttaa ymmärtämään paremmin sairauden syitä ja etenemistä. Tämä puolestaan voi johtaa kehittyneempien hoitostrategioiden luomiseen, jotka sisältävät tietoa heterogeenisyydestä tehon parantamiseksi.
Kasvaimen heterogeenisyyttä on havaittu leukemioissa , rinta- , eturauhas- , paksusuolen- , aivojen , ruokatorven , pään ja kaulan , virtsarakon ja gynekologisten karsinoomien , liposarkooman ja multippelin myelooman hoidossa .
Heterogeenisuuden mallit
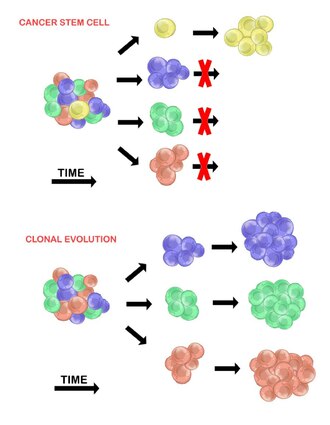
Kasvainsolujen heterogeenisyyttä selitetään kahdella mallilla. Nämä ovat syövän kantasolumalli ja klonaalisen evoluution malli. Mallit eivät sulje toisiaan pois, ja uskotaan, että ne molemmat edistävät heterogeenisyyttä vaihtelevassa määrin eri kasvaintyyppien välillä.
Syövän kantasolut
Syövän kantasolumalli väittää, että kasvainsolupopulaatiossa on vain pieni osa soluja, jotka ovat tuumorigeenisiä (kykeneviä muodostamaan kasvaimia). Näitä soluja kutsutaan syövän kantasoluiksi ( CSC ), ja niille on ominaista kyky sekä uudistaa itseään että erilaistua ei-tuumorigeenisiksi jälkeläisiksi. CSC -mallin mukaan kasvainsolujen välillä havaittu heterogeenisyys on seurausta kantasolujen eroista, joista ne ovat peräisin. Kantasolujen vaihtelevuus johtuu usein epigeneettisistä muutoksista, mutta se voi johtua myös CSC -populaation klonaalisesta kehityksestä, jossa edullisia geneettisiä mutaatioita voi kertyä CSC: hen ja niiden jälkeläisiin (katso alla).
Todisteet syövän kantasolumallista on osoitettu useissa kasvaintyypeissä, mukaan lukien leukemiat , glioblastooma , rintasyöpä ja eturauhassyöpä .
Kuitenkin CSC: n olemassaolosta keskustellaan edelleen. Yksi syy tähän on se, että CSC: iden markkereita on ollut vaikea toistaa useiden kasvainten välillä. Lisäksi menetelmät tuumorigeenisen potentiaalin määrittämiseksi käyttävät ksenograftimalleja . Näillä menetelmillä on luontaisia rajoituksia, kuten tarve kontrolloida immuunivastetta elinsiirtoeläimessä, ja merkittävä ero ympäristöolosuhteissa primaarikasvainpaikasta ksenograftikohtaan ( esim . Vaadittujen eksogeenisten molekyylien tai kofaktorien puuttuminen). Tämä on aiheuttanut epäilyksiä CSC -tulosten oikeellisuudesta ja johtopäätöksistä siitä, millä soluilla on tuumorigeeninen potentiaali.
Klooninen evoluutio
Peter Nowell ehdotti kloonien evoluutiomallia ensimmäisen kerran vuonna 1976 . Tässä mallissa kasvaimia syntyy yhdestä mutatoituneesta solusta, joka kerää lisää mutaatioita sen edetessä. Nämä muutokset synnyttävät lisää alapopulaatioita, ja jokaisella näistä osapopulaatioista on kyky jakautua ja mutatoida edelleen. Tämä heterogeenisyys voi synnyttää subklooneja, joilla on evoluutio -etu verrattuna muihin kasvainympäristössä , ja näistä alaklooneista voi tulla hallitsevia kasvaimessa ajan myötä. Kun tätä mallia ehdotettiin, se mahdollisti kasvaimen kasvun, hoidon epäonnistumisen ja kasvaimen aggression ymmärtämisen, joka esiintyy kasvaimen muodostumisen luonnollisen prosessin aikana.
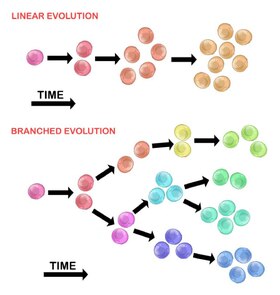
Alkuperäisen kasvainsolun kehitys voi tapahtua kahdella menetelmällä:
Lineaarinen laajennus
Peräkkäin järjestetyt mutaatiot kertyvät kuljettajageeneihin, tuumorisuppressorigeeneihin ja DNA: n korjausentsyymeihin , mikä johtaa kasvainsolujen kloonaaliseen laajentumiseen. Lineaarinen laajentuminen heijastaa vähemmän todennäköisesti pahanlaatuisen kasvaimen päätepistettä, koska mutaatioiden kertyminen on stokastista heterogeenisissä kasvaimissa.
Haarautunut laajennus
Laajentuminen useisiin subklonaalisiin populaatioihin tapahtuu halkaisumekanismin kautta. Tämä menetelmä liittyy enemmän kasvaimen heterogeenisuuteen kuin lineaariseen laajentumiseen. Mutaatioiden saaminen on satunnaista, koska genomin epävakaus lisääntyy jokaisen peräkkäisen sukupolven aikana. Pitkäaikainen mutaation kertyminen voi tarjota valikoivan edun kasvaimen etenemisen tietyissä vaiheissa. Kasvainmikroympäristön voi myös edistää kasvaimen kasvua, koska se pystyy muuttamaan valikoiva paineita, jotka kasvainsolut altistetaan.
Heterogeenisuuden tyypit ja syyt
Kasvainsolujen välillä on havaittu monenlaisia heterogeenisuuksia, jotka johtuvat sekä geneettisestä että ei-geneettisestä vaihtelevuudesta.
Geneettinen heterogeenisyys
Geneettinen heterogeenisyys on kasvaingenomien yhteinen piirre, ja se voi johtua useista lähteistä. Jotkut syövät alkavat, kun eksogeeniset tekijät aiheuttavat mutaatioita, kuten ultraviolettisäteily (ihosyöpä) ja tupakka (keuhkosyöpä). Yleisempi lähde on genominen epävakaus, joka syntyy usein, kun keskeiset säätelyreitit häiriintyvät soluissa. Joitakin esimerkkejä ovat heikentynyt DNA-korjausmekanismi , joka voi johtaa lisääntyviin replikaatiovirheisiin, ja viat mitoosikoneistossa, jotka mahdollistavat kokonaisten kromosomien suuren laajuuden lisääntymisen tai menetyksen . Lisäksi jotkin syöpähoidot ( esim . Temotsolomidi- ja muut kemoterapialääkkeet ) voivat lisätä geneettistä vaihtelua entisestään .
Mutaatiokasvaimen heterogeenisyys viittaa vaihteluihin mutaatiotaajuudessa eri geeneissä ja näytteissä, ja MutSig voi tutkia sitä . Mutaatioprosessien etiologia voi vaihdella huomattavasti saman tai eri syöpätyypin kasvainnäytteiden välillä, ja se voi ilmetä eri kontekstikohtaisista mutaatioprofiileista. Sitä voidaan tutkia COSMIC -mutaatioallekirjoituksilla tai MutaGene -ohjelmalla .
Muu heterogeenisyys
Kasvainsolut voivat myös osoittaa heterogeenisyyttä ilmentymisprofiiliensa välillä. Tämä johtuu usein epigeneettisistä muutoksista. Ekspressioallekirjoitusten vaihtelua on havaittu yksilön kasvainnäytteiden eri alueilla. Tutkijat ovat osoittaneet, että suppeneva vaikuttavia mutaatioita H3K36 metyylitransferaasi SETD2 ja histoni H3K4 demetylaasin KDM5C syntyi spatiaalisesti erillään kasvainleikkeissä. Samoin MTOR , solua säätelevää kinaasia koodaava geeni , on osoittautunut konstitutiivisesti aktiiviseksi, mikä lisää S6 -fosforylaatiota . Tämä aktiivinen fosforylaatio voi toimia biomarkkerina selkeän solun karsinoomassa.
Mekaaninen kemiallinen heterogeenisyys on elävien eukaryoottisolujen tunnusmerkki . Sillä on vaikutusta epigeneettiseen geenisäätelyyn . Heterogeeniset dynaamiset mekaanikemialliset prosessit säätelevät solupintojen ryhmän keskinäisiä suhteita tarttumisen kautta . Kasvaimen kehittymiseen ja leviämiseen liittyy muutos mekaanisen kemiallisen vuorovaikutusprosessin heterogeenisessa kaoottisessa dynamiikassa ryhmäsoluissa, mukaan lukien kasvainsolut, ja se on hierarkkinen syöpäpotilaille. Biologiset ilmiöt mekaanis heterogeenisyyden ehkä käyttää ero mahasyövän diagnostiikassa vastaan potilailla, joilla on tulehdusta ja mahan limakalvon ja lisätä antimetastaattinen aktiivisuus dendriittisolujen perustuu rokotteiden kun mekaanisesti heterogenisoidussa mikropartikkeleita tuumorisolujen käytetään niiden lastausta. On myös mahdollista menetelmällinen lähestymistapa, joka perustuu samanaikaisiin ultraäänikuvantamisdiagnostiikkatekniikoihin ja -hoitoon, koskien mekaanista ja kemiallista vaikutusta kasvaimia sisältävien lääkeaineiden yhdistelmiin.
Kasvaimen mikroympäristö
Kasvainsolujen välistä heterogeenisyyttä voidaan edelleen lisätä kasvaimen mikroympäristön heterogeenisyyden vuoksi . Kasvaimen alueelliset erot ( esim . Hapen saatavuus) aiheuttavat erilaisia selektiivisiä paineita kasvainsoluille, mikä johtaa laajempaan hallitsevien subkloonien kirjoon kasvaimen eri alueellisilla alueilla. Mikroympäristön vaikutus klonaaliseen dominointiin on myös todennäköinen syy monilla potilailla havaittujen primaaristen ja metastaattisten kasvainten väliselle heterogeenisuudelle sekä saman kasvaintyypin potilaiden välillä havaitulle kasvainten väliselle heterogeenisyydelle.
Vaikutukset ja haasteet
Hoidon kestävyys
Heterogeeniset kasvaimet voivat olla eri herkkiä sytotoksisille lääkkeille eri kloonipopulaatioissa. Tämä johtuu klonaalisista vuorovaikutuksista, jotka voivat estää tai muuttaa terapeuttista tehokkuutta, mikä on haaste onnistuneille hoidoille heterogeenisissä kasvaimissa (ja niiden heterogeenisissä etäpesäkkeissä).
Lääkkeen antaminen heterogeenisissä kasvaimissa tappaa harvoin kaikki kasvainsolut. Alkuperäinen heterogeeninen tuumoripopulaatio voi pullonkaulaa siten, että harvat lääkeresistentit solut (jos niitä on) selviävät. Tämä mahdollistaa resistenttien kasvainpopulaatioiden replikoitumisen ja uuden kasvaimen kasvattamisen haarautuvan evoluutiomekanismin kautta (katso edellä). Tuloksena oleva uudelleenkasvatettu kasvain on heterogeeninen ja vastustuskykyinen käytetylle lääkehoidolle. Uudelleenkasvanut kasvain voi myös palata aggressiivisemmin.
Sytotoksisten lääkkeiden antaminen johtaa usein kasvaimen alkuperäiseen kutistumiseen. Tämä edustaa alkuperäisten ei-resistenttien subklonaalisten populaatioiden tuhoutumista heterogeenisen kasvaimen sisällä, jättäen vain resistenttejä klooneja. Näillä vastustuskykyisillä klooneilla on nyt valikoiva etu ja ne voivat replikoitua kasvaimen uudelleenkasvamiseksi. Replikointi tapahtuu todennäköisesti haarautuvan evoluution kautta, mikä edistää kasvaimen heterogeenisyyttä. Uudelleenkasvatettu kasvain voi näyttää aggressiivisemmalta. Tämä johtuu kasvainsolujen lääkeresistentistä selektiivisestä edusta.
Biomarkkerin löytö
Kasvainten sisällä ja niiden välillä olevien geneettisten erojen vuoksi biomarkkereita, jotka voivat ennustaa hoitovastetta tai ennustetta, ei välttämättä ole laajasti sovellettavissa. On kuitenkin ehdotettu, että heterogeenisuustasoa voidaan käyttää biomarkkerina, koska heterogeenisemmät kasvaimet voivat sisältää todennäköisemmin hoitoa kestäviä alaklooneja. Lisätutkimuksia heterogeenisyyden huomioon ottavien biomarkkereiden kehittämisestä on edelleen kesken.
Mallijärjestelmät
Nykyisistä mallijärjestelmistä puuttuu tyypillisesti heterogeenisyys, joka nähdään ihmisen syövissä. Jotta kasvaimen heterogeenisuutta voitaisiin tutkia tarkasti, meidän on kehitettävä tarkempia prekliinisiä malleja. Yksi tällainen malli, potilaasta peräisin oleva tuumorin ksenograft , on osoittanut erinomaista hyötyä kasvaimen heterogeenisyyden säilyttämisessä samalla kun se on mahdollistanut yksityiskohtaisen tutkimuksen kloonisen kunnon kuljettajista. Kuitenkin edes tämä malli ei voi kuvata syövän koko monimutkaisuutta.
Nykyiset strategiat
Vaikka kasvaimen heterogeenisuuden tunnistamisen, karakterisoinnin ja hoidon ongelma on edelleen aktiivisen tutkimuksen kohteena, joitakin tehokkaita strategioita on ehdotettu, mukaan lukien sekä kokeelliset että laskennalliset ratkaisut.
Experimental
-
Keskitetty lähestymistapa: tietyn geneettisen lokuksen tai lokusjoukon analysointi . Tämä voi tapahtua havaitsemalla alleelinen epätasapaino (kasvaimen DNA: ta verrataan ituradan DNA: han), kromosomaalisten alueiden ( FISH ) monistaminen ja/tai sekvensoimalla spesifiset geenit. Tätä menetelmää käytetään seuraamaan tietyn kiinnostuksen kohteena olevan mutaation kehitystä tai vahvistamaan mutaatio, jonka tutkijat voivat epäillä kasvaimessa.
- Etuna: Mahdollistaa tiettyjen geenien ( esim. Kuljettajageenit, tuumorisuppressorit) analysoinnin . Prosessi on yksinkertainen, ja tulokset tulkitaan suoraan. FISH ja immunofluoresenssi mahdollistavat keskittymisen kasvainsolujen alatyyppeihin.
- Haitta: Rajoitettu analyysi kaipaa muita tärkeitä mutaatioita ja klonaalisen laajentumisen malleja. Alleelista epätasapainoa voi olla vaikea todentaa mikrosatelliittimarkkereilla, minkä vuoksi se on varmistettava riippumattomalla tekniikalla ( esim. FISH). FISH vaatii paljon soluja ja on työvoimavaltainen.
-
Genomin laajuinen lähestymistapa: koko genomin analysointi kasvainnäytteissä. Tämä voidaan tehdä karyotyypillä tai vertailevalla genomisella hybridisaatiolla (CGH) kromosomipoikkeavuuksien havaitsemiseksi. Kasvainbiopsioiden sekvensointi on yleistymässä.
- Etu: Ei luota aiempiin tietoihin varianttien tunnistamisessa. karyotyypillä tunnistetaan suuret kromosomipoikkeavuudet. CGH tarjoaa puolueettoman kattavuuden ja mahdollistaa pienimuotoisen alleelisen epätasapainon havaitsemisen (SNP-matriisit) . Sekvensointi tunnistaa kaikki variantit, jotka edistävät kasvaimen heterogeenisyyttä.
- Haitta: Vaihtoehtojen toiminnallisen vaikutuksen määrittäminen on vaikeaa ( eli neutraali tai patogeeninen). Rajoitettu resoluutio. Viljeltyjen solujen karyotyypitys voi olla suuntautunut valikoitujen tuumorisolupopulaatioiden suosituimpaan kasvuun. Rajoitettu resoluutio molemmissa menetelmissä. Koko genomin lähestymistapa voi tuottaa suuria määriä dataa ja olla vaikea tulkita.
- Multiregion-näytteenottostrategia: vaatii yleensä useita leikkauksen jälkeisiä kasvainnäytteitä mikrosekoitetun kasvaimen eri alueilta. On tärkeää välttää ei-pahanlaatuisten solujen kontaminaatiota, jotta varmistetaan geeniekspression ja geneettisen koostumuksen tarkka esitys vain kasvainsoluissa. Tuumorin DNA: n analysointi avaruudessa erotetuilla alueilla mahdollistaa kasvaimen heterogeenisuuden kolmiulotteisen evoluutiomallin rakentamisen. Monialueista näytteenottoa käytetään usein yhdessä genomin laajuisen lähestymistavan kanssa tämän 3D-heterogeenisuuden laajentumismallin luomiseksi.
- Pitkittäinen näytteenotto: kasvaimen etenemisen tai hoidon etenemisen kautta on joissakin tapauksissa hyödynnetty kasvaimenäytteiden ottamista useiden ajankohtien aikana. Tätä on ehdotettu luotettavaksi menetelmäksi klonaalisen evoluution seurantaan. Tämä tekniikka osoittautuu kuitenkin haastavaksi käytännössä, koska se vaatii säännöllistä invasiivista biopsiaa. Uusi tutkimus veressä kiertävän soluttoman kasvain-DNA: n hyödyntämisestä voi tarjota ei-invasiivisen tavan tunnistaa biomarkkerit koko hoidon ajan. Pitkittäinen näytteenotto yhdessä genomin laajuisen lähestymistavan kanssa mahdollistaa kertyneiden kasvainsolumutaatioiden tunnistamisen ajan kuluessa. Tämä voi puolestaan tunnistaa keskeiset kuljettajan mutaatiot (nähdään alkuperäisissä kasvainnäytteissä).
- Mukautuvaa hoitoa voidaan käyttää estämään kasvaimen lisäkasvua säätämällä lääkkeen annosta ja lääkkeen antamisen ajoitusta kasvaimen vasteen perusteella. Tämän strategian oletetaan estävän resistenttejä variantteja hallitsemasta kasvainta. Sen soveltamista on kuitenkin tutkittava enemmän.
Jaksotus
-
Bulk kasvain sekvensointi voidaan käyttää, jossa DNA uutetaan seos kasvainsolujen ja analysoitiin kaikki kerralla. Heterogeenisten kasvainpopulaatioiden (subkloonien) läsnäolo tuo lisähaasteita, kuten:
- Kyvyttömyys havaita mutaatioita harvinaisissa alaklooneissa. Koska nämä mutaatiot esiintyvät harvassa taajuudessa yhdistetyssä näytteessä, niitä ei voi erottaa taustamelusta. Kuitenkin monia variantti -soittajia kehitetään aktiivisesti, jotka on erityisesti suunniteltu syöpätietoja varten ja joiden tarkoituksena on tunnistaa harvinaisia variantteja, joita esiintyy pienemmissä subklonaalisissa populaatioissa. Näiden tyypillisesti hyödyntävät täsmäsi normaali DNA keinona erottaa todellisen somaattisten vaihtelu päässä ituradan vaihtelu ja tausta sekvensointi virhe.
- Kyvyttömyys määrittää, mitkä alakloonit sisältävät jokaisen mutaation. Koska tiedot on yhdistetty, ei ole selvää, mitkä mutaatiot esiintyvät samanaikaisesti ja mistä populaatioista ne ovat peräisin. Kehitetään uusia työkaluja, jotka yrittävät ratkaista kloonaalisen rakenteen käyttämällä havaittujen mutaatioiden alleelitaajuuksia .
-
Yksisoluinen sekvensointi on uusi tekniikka, joka on arvokas kasvaimen heterogeenisuuden arvioimiseksi, koska se voi luonnehtia yksittäisiä kasvainsoluja. Tämä tarkoittaa, että useiden eri solujen koko mutaatioprofiili voidaan määrittää ilman epäselvyyttä. Vaikka nykyisellä tekniikalla on vaikea arvioida riittävän paljon yksittäisiä soluja tilastollisen tehon saamiseksi, yksisoluisista kasvaintiedoista on useita etuja, mukaan lukien:
- Kyky rakentaa filogeeninen puu, joka näyttää kasvainpopulaatioiden kehityksen. Käyttämällä kokonaisten genomien sekvenssejä tai SNP- pohjaisia pseudosekvenssejä yksittäisistä soluista voidaan arvioida alakloonien kehitys. Tämä mahdollistaa sellaisten populaatioiden tunnistamisen, jotka ovat pysyneet ajan mittaan, ja voi kaventaa niiden mutaatioiden luetteloa, jotka voivat antaa kasvuedun tai hoitoresistenssin tietyille alaklooneille. Algoritmeja, joilla päätellään tuumorifylogeneesi yksisoluisen DNA: n sekvensointitiedoista, ovat SCITE, OncoNEM, SiFit, SiCloneFit, PhISCS ja PhISCS-BnB.
- Leikkaussekvensointi voidaan tehdä useista yksittäisen kiinteän kasvaimen osista, ja mutaatiotaajuuksien vaihtelu osien välillä voidaan analysoida kloonaalisen rakenteen päättämiseksi. Tämän lähestymistavan etuja yksittäiseen sekvensointiin verrattuna ovat enemmän tilastollista tehoa ja tarkempien tietojen saatavuus näytteiden spatiaalisesta sijainnista. Jälkimmäistä voidaan käyttää päättämään kloonien taajuus osissa ja antamaan tietoa siitä, miten kasvain kehittyy avaruudessa. Jotta voitaisiin päätellä kloonien genotyypit ja fylogeneettiset puut, jotka mallinnavat kasvaimen kehityksen ajassa, kehitettiin useita laskentamenetelmiä, mukaan lukien Clomial, cloneHD, PhyloWGS, PyClone, Cloe, phyC, Canopy, TargetClone , ddClone, PASTRI, GLClone, TRaIT, WSCUnmi, SCITE., ThetA, SIFA, Sclust, SeqClone, CALDER, BAMSE, Meltos, SubMARine, RNDCLONE, Conifer ja DEVOLUTION.