Taitto@home - Folding@home
 | |
| Alkuperäinen kirjoittaja | Vijay Pande |
|---|---|
| Kehittäjä (t) | Pande Laboratory, Sony , Nvidia , ATI Technologies, Joseph Coffland, Cauldron Development |
| Ensimmäinen julkaisu | 1. lokakuuta 2000 |
| Vakaa julkaisu | 7.6.21 / 23. lokakuuta 2020
|
| Käyttöjärjestelmä | Microsoft Windows , macOS , Linux , PlayStation 3 (poistettu laiteohjelmistoversiosta 4.30 alkaen) |
| Alusta | IA-32 , x86-64 |
| Saatavilla | Englanti |
| Tyyppi | Hajautettu tietojenkäsittely |
| Lisenssi | Oma ohjelmisto |
| Verkkosivusto | taitto koti |
Folding@home ( FAH tai F@h ) on hajautettu laskentaprojekti, jonka tarkoituksena on auttaa tutkijoita kehittämään uusia lääkkeitä erilaisiin sairauksiin simuloimalla proteiinidynamiikkaa. Tämä sisältää proteiinien taittamisprosessin ja proteiinien liikkeet, ja se perustuu vapaaehtoisten henkilökohtaisilla tietokoneilla suoritettaviin simulaatioihin. Folding@home sijaitsee tällä hetkellä Washingtonin yliopistossa St. Louisissa ja sitä johtaa Greg Bowman, entinen Vijay Panden opiskelija .
Projekti käyttää grafiikkaprosessointiyksiköitä (GPU), keskusyksiköitä (CPU) ja ARM -prosessoreita, kuten Raspberry Pi -laitteessa olevia, hajautettua tietojenkäsittelyä ja tieteellistä tutkimusta varten. Projektissa käytetään tilastollisia simulointimenetelmiä, jotka ovat paradigman muutos perinteisistä laskentamenetelmistä. Osana asiakas-palvelin mallia verkon arkkitehtuuri , The vapaaehtoisesti annetut koneet saavat kukin kappaletta simulaation (työyksiköksi), suorittamaan ne, ja palauttaa ne hankkeen tietokantapalvelimet , kun yksiköt kootaan yleistä simulointi. Vapaaehtoiset voivat seurata osallistumistaan Folding@home-verkkosivustolla, mikä tekee vapaaehtoisten osallistumisesta kilpailukykyistä ja kannustaa osallistumaan pitkällä aikavälillä.
Folding@home on yksi maailman nopeimmista tietokonejärjestelmistä. Koska kiinnostus hankkeeseen on lisääntynyt COVID-19-pandemian vuoksi , järjestelmä saavutti noin 1,22 eksaflopin nopeuden maaliskuun 2020 loppuun mennessä ja saavutti 2,43 eksafloppia 12. huhtikuuta 2020, mikä tekee siitä maailman ensimmäisen exaflop-tietokonejärjestelmän . Tämä suuren mittakaavan laskentaverkoston suorituskyky on antanut tutkijoille mahdollisuuden suorittaa laskennallisesti kalliita atomitason simulaatioita proteiinin taittumisesta tuhansia kertoja pidempään kuin aiemmin saavutettu. Pande Lab on julkaissut 1. lokakuuta 2000 lähtien 225 tieteellistä tutkimuspaperia suorana Folding@home -ohjelman tuloksena. Hankkeen simulaatioiden tulokset sopivat hyvin kokeisiin.
Tausta

Proteiinit ovat olennainen osa monia biologisia toimintoja ja osallistuvat lähes kaikkiin biologisten solujen prosesseihin . Ne toimivat usein entsyymeinä ja suorittavat biokemiallisia reaktioita, mukaan lukien solun signalointi , molekyylikuljetus ja solun säätely . Rakenne -elementteinä jotkut proteiinit toimivat solujen luurankoina ja vasta -aineina , kun taas muut proteiinit osallistuvat immuunijärjestelmään . Ennen kuin proteiini voi ottaa nämä roolit, sen on taitettava toiminnalliseksi kolmiulotteiseksi rakenteeksi , prosessi, joka tapahtuu usein spontaanisti ja joka on riippuvainen vuorovaikutuksista sen aminohapposekvenssin sisällä ja aminohappojen vuorovaikutuksesta ympäristönsä kanssa. Proteiinin taittumista ohjaa etsintä löytää proteiinin energisesti edullisin konformaatio eli sen alkuperäinen tila . Siten proteiinin taittumisen ymmärtäminen on kriittistä, jotta voidaan ymmärtää, mitä proteiini tekee ja miten se toimii, ja sitä pidetään laskennallisen biologian pyhänä graalina . Huolimatta taittumisesta, joka tapahtuu tungosta solukkoympäristössä , se etenee tyypillisesti sujuvasti. Kuitenkin proteiinin kemiallisten ominaisuuksien tai muiden tekijöiden vuoksi proteiinit voivat taittua väärin , eli taittaa väärän reitin alas ja päätyä epämuodostumaan. Ellei solumekanismi voi tuhota tai taittaa väärin laskostuneita proteiineja, ne voivat myöhemmin kasautua ja aiheuttaa erilaisia heikentäviä sairauksia. Näitä prosesseja tutkivia laboratoriokokeita voidaan rajoittaa laajuudeltaan ja atomien yksityiskohdiltaan, mikä saa tutkijat käyttämään fysiikkaan perustuvia laskentamalleja, jotka kokeita täydentäessään pyrkivät antamaan täydellisemmän kuvan proteiinien taittumisesta, väärinkäytöstä ja aggregoinnista.
Proteiinien konformaation tai konfiguraatiotilan monimutkaisuuden (joukko mahdollisia muotoja, joita proteiini voi ottaa) ja laskentatehon rajoitusten vuoksi kaikkien atomien molekyylidynamiikan simulaatioita on rajoitettu voimakkaasti niiden aikataulussa. Vaikka useimmat proteiinit taittuvat tyypillisesti millisekuntien suuruusluokassa, ennen vuotta 2010 simulaatiot voisivat saavuttaa vain nanosekunnista mikrosekuntiin. Yleiskäyttöisiä supertietokoneita on käytetty simuloimaan proteiinien taittamista, mutta tällaiset järjestelmät ovat luonnostaan kalliita ja tyypillisesti jaettuja monien tutkimusryhmien kesken. Lisäksi koska kineettisten mallien laskennat tapahtuvat sarjassa, perinteisten molekyylisimulaatioiden voimakas skaalaus näihin arkkitehtuureihin on poikkeuksellisen vaikeaa. Lisäksi, koska proteiinien taitto on stokastinen prosessi (eli satunnainen) ja voi vaihdella tilastollisesti ajan mittaan, on laskennallisesti haastavaa käyttää pitkiä simulaatioita kokonaisnäkemykseen taittoprosessista.
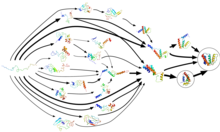
Proteiinin taittuminen ei tapahdu yhdessä vaiheessa. Sen sijaan proteiinit viettävät suurimman osan taittumisajastaan, joissakin tapauksissa lähes 96%, odottaen erilaisissa välittävissä konformaatiotiloissa , joista jokainen on paikallinen termodynaaminen vapaan energian minimi proteiinin energiamaisemassa . Läpi prosessia kutsutaan mukautuva näytteenotto , joissa on nämä konformaatiot käyttävät Folding @ kotiin lähtökohtatilannetta joukko simulointi liikeradat. Kun simulaatiot löytävät lisää konformaatioita, liikeradat käynnistetään niistä uudelleen ja tästä syklisestä prosessista luodaan vähitellen Markovin tilamalli (MSM). MSMS ovat diskreettiaikaista master yhtälö malleja, jotka kuvaavat biomolekyylien konformationaalisen ja energiamaisema joukkona erillisiä rakenteita ja lyhyet siirtymät niiden välillä. Mukautuva näytteenotto Markovin tilamallimenetelmä lisää merkittävästi simulaation tehokkuutta, koska se välttää laskennan paikallisen energiaminimin sisällä, ja se soveltuu hajautettuun laskentaan (mukaan lukien GPUGRID ), koska se mahdollistaa lyhyiden, riippumattomien simulointiratojen tilastollisen aggregoinnin. Markovin tilamallin rakentamiseen kuluva aika on kääntäen verrannollinen suoritettavien rinnakkaissimulaatioiden määrään eli käytettävissä olevien prosessorien määrään. Toisin sanoen se saavuttaa lineaarisen rinnakkaisuuden , mikä johtaa noin neljän suuruusluokan lyhenemiseen sarjalaskennan kokonaisajassa. Valmis MSM voi sisältää kymmeniä tuhansia näytetiloja proteiinin vaiheavusta (kaikki konformaatiot, joita proteiini voi ottaa vastaan) ja niiden välisiä siirtymiä. Malli havainnollistaa taittumistapahtumia ja reittejä (eli reittejä), ja tutkijat voivat myöhemmin käyttää kineettistä ryhmittelyä tarkastellakseen karkeasti esitettyä esitystä muuten erittäin yksityiskohtaisesta mallista. He voivat käyttää näitä MSM: iä paljastamaan kuinka proteiinit vääristyvät ja vertaamaan simulaatioita kvantitatiivisesti kokeisiin.
Vuosien 2000 ja 2010 välisenä aikana Folding@home -tutkittujen proteiinien pituus on kasvanut nelinkertaiseksi, kun taas proteiinien taittamissimulaatioiden aikataulu on kasvanut kuusi suuruusluokkaa. Vuonna 2002 Folding@home käytti Markovin osavaltion malleja suorittamaan noin miljoonan CPU -päivän simulaatioita useiden kuukausien aikana, ja vuonna 2011 MSM: t rinnastivat toisen simulaation, joka vaati yhteensä 10 miljoonaa CPU -tuntia laskentaa. Tammikuussa 2010 Folding@home simuloi MSM-yhdisteitä hitaasti taittuvan 32- tähteisen NTL9-proteiinin dynamiikkaan 1,52 millisekuntiin. Malli koostui monista yksittäisistä lentoreiteistä, kumpikin kaksi suuruusluokkaa lyhyempi, ja se tarjosi ennennäkemättömän yksityiskohtaista tietoa proteiinin energiamaisemasta. Vuonna 2010 Folding @ home tutkija Gregory Bowman sai Thomas Kuhn Paradigm Shift palkinnon päässä American Chemical Society for kehittämistä avoimen lähdekoodin MSMBuilder ohjelmistoja ja saavuttamiseksi määrällisten välisen teoriaa ja kokeilua. Pande sai työstään vuoden 2012 Michael ja Kate Bárány -palkinnon nuorille tutkijoille "kenttämäärittelyjen ja kenttämuutosten laskentamenetelmien kehittämisestä johtavien teoreettisten mallien tuottamiseksi proteiini- ja RNA- taitoksille" ja Irving Sigalin nuoren tutkijan palkinnon vuonna 2006. hänen simulaatiotuloksensa, jotka "ovat kannustaneet uudelleen tutkimaan sekä ensemble- että yksittäimolekyylimittausten merkitystä, mikä tekee Panden ponnisteluista uraauurtavan panoksen simulointimenetelmiin".
Esimerkkejä sovelluksesta biolääketieteellisessä tutkimuksessa
Proteiinin vääristyminen voi aiheuttaa erilaisia sairauksia, kuten Alzheimerin taudin, syövän , Creutzfeldt-Jakobin taudin , kystisen fibroosin , Huntingtonin taudin, sirppisoluanemian ja tyypin II diabeteksen . Virusten, kuten HIV: n ja influenssan, aiheuttamiin solutulehduksiin liittyy myös solukalvojen taittumistapahtumia . Kun proteiinin vääristyminen on ymmärretty paremmin, voidaan kehittää hoitoja, jotka lisäävät solujen luonnollista kykyä säätää proteiinin taittumista. Tällaisia hoitomuotoja ovat muokattujen molekyylien käyttö tietyn proteiinin tuotannon muuttamiseksi, väärin taitetun proteiinin tuhoamiseksi tai taittoprosessin tukemiseksi. Laskennallisen molekyylimallinnuksen ja kokeellisen analyysin yhdistelmällä on mahdollisuus muokata perustavanlaatuisesti molekyylilääketieteen tulevaisuutta ja lääkkeiden järkevää suunnittelua , kuten nopeuttaa ja alentaa lääkkeiden löytämisen kustannuksia . Folding@home -palvelun ensimmäisen viiden vuoden tavoitteena oli edistyä taittumisen ymmärtämisessä, kun taas nykyinen tavoite on ymmärtää väärin taittuminen ja siihen liittyvät sairaudet, erityisesti Alzheimerin tauti.
Folding@home -sovelluksella suoritettavia simulaatioita käytetään laboratoriokokeiden yhteydessä, mutta tutkijat voivat käyttää niitä tutkiakseen, miten taitto in vitro eroaa taittumisesta natiivissa soluympäristössä. Tämä on edullista tutkittaessa taittumisen, väärinkäytön ja niiden suhteiden sairauksiin näkökohtia, joita on vaikea havaita kokeellisesti. Esimerkiksi vuonna 2011 Folding@home simuloi proteiinien taittumista ribosomaalisen poistumistunnelin sisällä auttaakseen tutkijoita ymmärtämään paremmin, miten luonnollinen sulkeutuminen ja ahtautuminen voivat vaikuttaa taittoprosessiin. Lisäksi tiedemiehet käyttävät tyypillisesti kemiallisia denaturointiaineita proteiinien avaamiseksi niiden vakaasta alkuperätilasta. Ei ole yleisesti tiedossa, miten denaturoiva aine vaikuttaa proteiinin uudelleenlaskostumiseen, ja on vaikea kokeellisesti määrittää, sisältävätkö nämä denaturoidut tilat jäännerakenteita, jotka voivat vaikuttaa taittumiskäyttäytymiseen. Vuonna 2010 Folding@home käytti grafiikkasuorittimia simuloidakseen proteiini L: n avautumattomia tiloja ja ennusti sen romahtumisnopeuden tiiviisti sopusoinnussa kokeellisten tulosten kanssa.
Hankkeen suuret tietojoukot ovat muiden tutkijoiden vapaasti käytettävissä pyynnöstä, ja osaan niistä pääsee Folding@home -verkkosivustolta. Pande -laboratorio on tehnyt yhteistyötä muiden molekyylidynamiikan järjestelmien, kuten Blue Gene -supertietokoneen kanssa, ja he jakavat Folding@home -ohjelmiston muiden tutkijoiden kanssa, jotta Folding@home -ohjelmasta hyötyneet algoritmit voivat auttaa muita tieteellisiä alueita. Vuonna 2011 he julkaisivat avoimen lähdekoodin Copernicus-ohjelmiston, joka perustuu Folding@home: n MSM: ään ja muihin rinnakkaismenetelmiin ja jonka tavoitteena on parantaa molekyylisimulaatioiden tehokkuutta ja skaalausta suurissa tietokoneryhmissä tai supertietokoneissa . Yhteenvedot kaikista Folding@home -tieteellisistä havainnoista julkaistaan Folding@home -verkkosivustolla julkaisemisen jälkeen.
Alzheimerin tauti
Alzheimerin tauti on parantumaton neurodegeneratiivinen sairaus, joka vaikuttaa useimmiten vanhuksiin ja joka muodostaa yli puolet kaikista dementiatapauksista . Sen tarkka syy on edelleen tuntematon, mutta tauti tunnistetaan proteiinivääristymissairaudeksi . Alzheimerin liittyy myrkyllisiä kasaumien ja amyloidi beeta (Ap) peptidi , Ap: n aiheuttamia virhelaskostumisen ja paakkuuntuminen yhdessä muiden Ap-peptidien. Nämä Aβ -aggregaatit kasvavat sitten merkittävästi suuremmiksi seniiliplakeiksi, jotka ovat Alzheimerin taudin patologinen merkki. Näiden aggregaattien heterogeenisyyden vuoksi kokeellisilla menetelmillä, kuten röntgenkristallografialla ja ydinmagneettisella resonanssilla (NMR), on ollut vaikeuksia niiden rakenteiden karakterisoinnissa. Lisäksi Aβ -aggregaation atomisimulaatiot ovat erittäin vaativia laskennallisesti niiden koon ja monimutkaisuuden vuoksi.
Aβ -aggregaation estäminen on lupaava menetelmä terapeuttisten lääkkeiden kehittämiseen Alzheimerin tautia varten, Naeemin ja Fazilin mukaan kirjallisuuskatsauksessa . Vuonna 2008 Folding@home simuloi Aβ -aggregaation dynamiikkaa atomien yksityiskohdissa kymmenien sekuntien suuruisten aikataulujen aikana. Aiemmat tutkimukset pystyivät simuloimaan vain noin 10 mikrosekuntia. Folding@home pystyi simuloimaan Aβ -taittumista kuusi suuruusluokkaa pidempään kuin aiemmin mahdollista. Tutkijat käyttivät tämän tutkimuksen tuloksia tunnistaakseen beeta -hiusneulan, joka oli merkittävä molekyylivuorovaikutuksen lähde rakenteessa. Tutkimus auttoi Pande -laboratoriota valmistelemaan tulevia aggregaatiotutkimuksia varten ja lisätutkimuksia varten, jotta löydettäisiin pieni peptidi, joka voi vakauttaa aggregaatioprosessin.
Joulukuussa 2008 Folding@home löysi useita pieniä lääkekandidaatteja, jotka näyttävät estävän Aβ -aggregaattien toksisuutta. Vuonna 2010 näitä lääkeainejohtoja testattiin tiiviissä yhteistyössä Protein Folding Machinery Centerin kanssa biologisella kudoksella . Vuonna 2011, Folding @ koti valmistui simulaatioita useita mutaatioita Ap, jotka näyttävät vakauttaa aggregaatin muodostumista, jotka voisivat auttaa kehittämään terapeuttisen lääkehoidot taudin ja suurta apua kokeellisen ydinmagneettiresonanssispektroskopialla tutkimukset Ap oligomeerien . Myöhemmin samana vuonna Folding@home aloitti eri Ap -fragmenttien simulaatiot sen määrittämiseksi, kuinka erilaiset luonnolliset entsyymit vaikuttavat Ap: n rakenteeseen ja taittumiseen.
Huntingtonin tauti
Huntingtonin tauti on neurodegeneratiivinen geneettinen sairaus, joka liittyy proteiinien väärinkäyttöön ja aggregaatioon. Liiallinen toistot ja glutamiini aminohappo N-päässä on huntingtin proteiini aiheuttaa aggregaatiota, ja vaikka käyttäytyminen toistuu ei täysin ymmärretä, se johtaa siihen, että liittyvän kognitiivisen heikkenemisen tauti. Kuten muillakin kiviaineksilla, sen rakenteen määrittäminen kokeellisesti on vaikeaa. Tutkijat käyttävät Folding @ home tutkia rakenteen huntingtin proteiinin aggregaatti ja ennustaa, miten se muodostaa, avustamalla rationaalisesta lääkeaine- suunnittelusta menetelmiä lopettaa aggregaatin muodostumista. Huntingtin -proteiinin N17 -fragmentti nopeuttaa tätä aggregaatiota, ja vaikka on ehdotettu useita mekanismeja, sen tarkka rooli tässä prosessissa on suurelta osin tuntematon. Folding@home on simuloinut tätä ja muita fragmentteja selventääkseen roolejaan taudissa. Vuodesta 2008 lähtien sen lääkemuotoilumenetelmiä Alzheimerin tautiin on sovellettu Huntingtonin tautiin.
Syöpä
Enemmän kuin puoli kaikista tunnetut syövät liittyy mutaatiot ja p53 , joka on tuumorisuppressorin proteiinin läsnä jokaisessa solussa, joka säätelee solusyklin ja signaalit solukuoleman , jos vaurioita DNA . Spesifiset mutaatiot p53: ssa voivat häiritä näitä toimintoja, jolloin epänormaali solu voi jatkaa kasvuaan valvomatta, mikä johtaa kasvainten kehittymiseen . Näiden mutaatioiden analyysi auttaa selittämään p53-syöpien perimmäiset syyt. Vuonna 2004, Folding @ home käytettiin suorittamaan ensimmäisen molekyylidynamiikka tutkimus uudelleenlaskostus- p53: n proteiinin dimeeri käytettäessä kaikki-atomin simulointi vettä . Simulaation tulokset sopivat kokeellisiin havaintoihin ja antoivat tietoa dimeerin uudelleen taittamisesta, jota aiemmin ei ollut mahdollista saada. Tämä oli ensimmäinen vertaisarvioitu julkaisu syövästä hajautetusta tietokonehankkeesta. Seuraavana vuonna Folding@home käytti uutta menetelmää tunnistaa tietyn proteiinin vakauden kannalta ratkaisevat aminohapot, jota käytettiin sitten p53: n mutaatioiden tutkimiseen. Menetelmä onnistui kohtuullisesti syöpää edistävien mutaatioiden tunnistamisessa ja määritti sellaisten mutaatioiden vaikutukset, joita ei muuten voitu mitata kokeellisesti.
Folding@home -laitetta käytetään myös tutkimaan proteiinikaperoneja , lämpöshokkiproteiineja, joilla on keskeinen rooli solujen selviytymisessä auttamalla muiden proteiinien taittamisessa solun tungosta ja kemiallisesti rasittavassa ympäristössä. Nopeasti kasvavat syöpäsolut tukeutuvat tiettyihin chaperoneihin, ja joillakin chaperoneilla on avainroolit kemoterapiaresistenssissä . Näiden erityisten chaperonien estämistä pidetään mahdollisina toimintatapoina tehokkaille kemoterapialääkkeille tai syövän leviämisen vähentämiselle. Käyttämällä Folding@home -palvelua ja tiiviissä yhteistyössä Protein Folding Machinery Centerin kanssa Pande -laboratorio toivoo löytävänsä lääkkeen, joka estää syöpäsoluissa mukana olevia saattajia. Tutkijat käyttävät myös Folding@home -ohjelmaa muiden syöpään liittyvien molekyylien, kuten Src -kinaasientsyymin , ja joidenkin kaiverretun homeodomeenin muotojen tutkimiseen : suuri proteiini, joka voi olla mukana monissa sairauksissa, mukaan lukien syöpä. Vuonna 2011, Folding @ home alkoi simulaatioita dynamiikan pieni knottin proteiini Eeti, joka voi tunnistaa karsinoomia in kuvantamisessa skannaa sitoutumalla pinnan reseptoreihin syöpäsoluja.
Interleukiini-2 (IL-2) on proteiini, joka auttaa T-solujen ja immuunijärjestelmän hyökkäyksen taudinaiheuttajia ja kasvaimia. Sen käyttöä syövän hoidossa on kuitenkin rajoitettu vakavien sivuvaikutusten, kuten keuhkopöhön, vuoksi . IL-2 sitoutuu näihin keuhkosoluihin eri tavalla kuin T-soluihin, joten IL-2 -tutkimukseen kuuluu näiden sitoutumismekanismien erojen ymmärtäminen. Vuonna 2012 Folding@home auttoi löytämään IL-2: n mutanttimuodon, joka on kolmesataa kertaa tehokkaampi immuunijärjestelmän roolissaan, mutta jolla on vähemmän sivuvaikutuksia. Kokeissa tämä muutettu muoto ylitti merkittävästi luonnollisen IL-2: n kasvaimen kasvun estämisessä. Lääkeyhtiöt ovat ilmaisseet kiinnostuksensa mutanttimolekyyliin, ja kansalliset terveyslaitokset testaavat sitä monenlaisia kasvainmalleja vastaan yrittäessään nopeuttaa sen kehitystä terapeuttisena aineena.
Osteogenesis imperfecta
Osteogenesis imperfecta , joka tunnetaan hauraana luusairautena, on parantumaton geneettinen luusairaus, joka voi olla tappava. Taudista kärsivät eivät pysty muodostamaan toiminnallista sidekudosta. Tämä johtuu useimmiten tyypin I kollageenin mutaatiosta , joka täyttää erilaisia rakenteellisia rooleja ja on yleisin proteiini nisäkkäissä . Mutaatio aiheuttaa muodonmuutoksen kollageenin kolmoiskierrerakenteessa , joka jos ei luonnollisesti tuhoudu, johtaa epänormaaliin ja heikentyneeseen luukudokseen. Vuonna 2005 Folding@home testasi uutta kvanttimekaanista menetelmää, joka parani aiempiin simulaatiomenetelmiin verrattuna ja joka voi olla hyödyllinen tulevissa kollageenin laskentatutkimuksissa. Vaikka tutkijat ovat käyttäneet Folding@homea kollageenin taittumisen ja väärinkäytön tutkimiseen, kiinnostus on pilottihanke verrattuna Alzheimerin ja Huntingtonin tutkimuksiin.
Virukset
Folding@home auttaa tutkimuksessa, jolla estetään joidenkin virusten , kuten influenssan ja HIV: n , tunnistaminen ja pääsy biologisiin soluihin . Vuonna 2011 Folding@home aloitti HIV: n keskeisen komponentin RNaasi H -entsyymin dynamiikan simuloinnin yrittääkseen suunnitella lääkkeitä sen deaktivoimiseksi. Folding@home on myös käytetty kalvon fuusion tutkimiseen , joka on olennainen tapahtuma virusinfektioille ja monille biologisille toiminnoille. Tämä fuusio sisältää viruksen fuusioproteiinien konformaatiomuutoksia ja proteiinien telakointia , mutta fuusion tarkat molekyylimekanismit ovat suurelta osin tuntemattomia. Fuusio -tapahtumat voivat käsittää yli puoli miljoonaa atomia vuorovaikutuksessa satojen mikrosekuntien ajan. Tämä monimutkaisuus rajoittaa tyypilliset tietokonesimulaatiot noin kymmeneen tuhanteen atomiin kymmenien nanosekuntien aikana: ero on useita suuruusluokkia. Membraanifuusion mekanismien ennustamiseen tarkoitettujen mallien kehittäminen auttaa tieteellisessä käsityksessä siitä, miten kohdistaa prosessi viruslääkkeillä. Vuonna 2006 tutkijat käyttivät Markovin osavaltion malleja ja Folding@home -verkkoa löytääkseen kaksi reittiä fuusioon ja saadakseen muita mekaanisia näkemyksiä.
Seuraavat yksityiskohtaiset simulaatiot mistä Folding @ home pieniä soluja kutsutaan rakkulat , vuonna 2007 Pande lab käyttöön uuden laskentamenetelmän mitata topologian sen rakenteellisia muutoksia fuusio. Vuonna 2009 tutkijat tutkivat Folding@home -tutkimusta influenssahemagglutiniinin mutaatioista , joka on proteiini, joka kiinnittää viruksen isäntäsoluunsa ja auttaa virustautumaan. Mutaatiot hemagglutiniiniin vaikuttavat siihen, kuinka hyvin proteiini sitoutuu isännän solun pinnan reseptorimolekyyleihin , mikä määrittää, kuinka tarttuva viruskanta on isäntäorganismille. Tieto hemagglutiniinimutaatioiden vaikutuksista auttaa viruslääkkeiden kehittämisessä . Vuodesta 2012 lähtien Folding@home simuloi edelleen hemagglutiniinin taittumista ja vuorovaikutusta täydentäen Virginian yliopiston kokeellisia tutkimuksia .
Maaliskuussa 2020 Folding@home käynnisti ohjelman, jonka tarkoituksena on auttaa tutkijoita ympäri maailmaa, jotka etsivät parannuskeinoa ja oppivat lisää koronaviruspandemiasta . Alkuperäinen hankkeiden aalto simuloi SARS-CoV-2-viruksen ja siihen liittyvän SARS-CoV-viruksen mahdollisesti lääkkeeseen kelpaavia proteiinikohteita, joista on saatavilla huomattavasti enemmän tietoa.
Lääkkeen suunnittelu
Lääkkeet toimivat mukaan sitoutumisen ja tiettyihin paikkoihin kohdemolekyyleillä ja aiheuttaa jonkin verran halutun muutoksen, kuten käytöstä kohteena tai aiheuttaa konformationaalisen muutoksen . Ihannetapauksessa lääkkeen tulisi toimia hyvin spesifisesti ja sitoutua vain kohteeseensa häiritsemättä muita biologisia toimintoja. On kuitenkin vaikea määrittää tarkasti, missä ja kuinka tiiviisti kaksi molekyyliä sitoutuvat. Laskentatehon rajoitusten vuoksi in silico -menetelmien on yleensä vaihdettava nopeutta tarkkuuden vuoksi ; Käytä esimerkiksi nopeita proteiinitelakointimenetelmiä laskennallisesti kalliiden vapaan energian laskelmien sijasta . Folding@home -laskentatehon ansiosta tutkijat voivat käyttää molempia menetelmiä ja arvioida niiden tehokkuutta ja luotettavuutta. Tietokoneavusteinen lääkemuotoilu voi nopeuttaa ja alentaa lääkkeiden löytämisen kustannuksia. Vuonna 2010, Folding @ home käytetään MSMS ja vapaan energian laskelmiin ennustaa natiivin tilan villiiniä proteiinin sisällä 1,8 ångströmiä (Ä) keskivirheen (RMSD) päässä kiderakenne kokeellisesti määritetään röntgenkristallografialla . Tällä tarkkuudella on vaikutuksia tuleviin proteiinirakenteen ennustamismenetelmiin , myös luontaisesti rakenteettomiin proteiineihin . Tutkijat ovat käyttäneet Folding@home-tutkimusta lääkeresistenssin tutkimiseen tutkimalla vankomysiiniä , joka on viimeinen keino antibiootti , ja beetalaktamaasia , proteiinia, joka voi hajottaa antibiootteja, kuten penisilliiniä .
Kemiallinen aktiivisuus tapahtuu proteiinin aktiivista kohtaa pitkin . Perinteisiin lääkeaineiden suunnittelumenetelmiin kuuluu sitoutuminen tiukasti tähän kohtaan ja sen toiminnan estäminen olettaen, että kohdeproteiini on yhdessä jäykässä rakenteessa. Tämä lähestymistapa toimii kuitenkin vain noin 15%: lla kaikista proteiineista. Proteiinit sisältävät allosteerisia kohtia , jotka pieniin molekyyleihin sitoutuessaan voivat muuttaa proteiinin konformaatiota ja lopulta vaikuttaa proteiinin aktiivisuuteen. Nämä sivustot ovat houkuttelevia huumeiden kohteita, mutta niiden löytäminen on erittäin laskennallisesti kallista . Vuonna 2012, Folding @ home ja MSMS käytettiin tunnistamaan allosteerinen sivustoja kolme lääketieteellisesti merkityksellinen proteiineja: beeta-laktamaasi, interleukiini-2 , ja RNaasi H .
Noin puoli kaikki tunnetut antibiootit häiritsevät toimintaa on bakteerin ribosomin , suurten ja monimutkaisten biokemiallisten kone, joka suorittaa proteiinibiosynteesiin mukaan kääntäminen lähetti-RNA: proteiineihin. Makrolidiantibiootit tukkivat ribosomin poistumistunnelin ja estävät välttämättömien bakteeriproteiinien synteesin. Vuonna 2007 Pande -laboratorio sai apurahan uusien antibioottien tutkimiseen ja suunnitteluun. Vuonna 2008 he tutkivat Folding@home -sovellusta tämän tunnelin sisätilan ja kuinka tietyt molekyylit voivat vaikuttaa siihen. Ribosomin koko rakenne määritettiin vasta vuodesta 2011, ja Folding@home on myös simuloinut ribosomaalisia proteiineja , koska monet niiden toiminnoista ovat suurelta osin tuntemattomia.
Mahdollisia sovelluksia biolääketieteellisessä tutkimuksessa
Folding@home voi hyödyntää monia muita proteiinivääristymisen edistämiä sairauksia, jotta voidaan joko havaita väärin taitettu proteiinirakenne tai väärin taittuva kinetiikka ja auttaa lääkkeiden suunnittelussa tulevaisuudessa. Usein kuolemaan johtavat prionitaudit ovat merkittävimpiä.
Prionitaudit
Prioni (PrP) on transmembraaninen solun proteiini laajalti eukaryoottisoluissa . Nisäkkäillä sitä on enemmän keskushermostossa . Vaikka sen toimintaa ei tunneta, sen korkea säilyvyys lajien keskuudessa osoittaa tärkeän roolin solutoiminnassa. Konformationaalinen muutos normaalista prioniproteiinista (PrPc, lyhenne sanoista cellular) sairaudeksi, joka aiheuttaa isoformin PrPSc (prototyyppinen prionitauti - scrapie ) aiheuttaa joukon sairauksia, jotka tunnetaan yleisesti nimellä tarttuvat spongiformiset enkefalopatiat (TSE), mukaan lukien naudan spongiforminen enkefalopatia ( BSE) nautaeläimissä, Creutzfeldt-Jakobin tauti (CJD) ja kuolemaan johtava unettomuus ihmisissä, krooninen tuhlaustauti (CWD) hirviperheessä. Konformationaalinen muutos hyväksytään laajalti proteiinivääristymisen seurauksena . Se, mikä erottaa TSE: t muista proteiinivääristymissairauksista, on sen tarttuva luonne. Tarttuvan PrPSc: n "kylvö", joko spontaanisti, perinnöllinen tai saastuneiden kudosten altistuminen, voi aiheuttaa ketjureaktion, joka muuttaa normaalin PrPc: n fibrillien aggregaateiksi tai amyloidimaisiksi plakeiksi, jotka koostuvat PrPSc: stä.
PrPSc: n molekyylirakennetta ei ole täysin karakterisoitu sen aggregoidun luonteen vuoksi. Kumpaakaan ei tiedetä paljon proteiinin väärinkäytön mekanismista eikä sen kinetiikasta . Käyttämällä PrPc: n tunnettua rakennetta ja jäljempänä kuvattujen in vitro- ja in vivo -tutkimusten tuloksia, Folding@home voisi olla arvokas selvittämään, kuinka PrPSc muodostuu ja miten tarttuva proteiini järjestää itsensä muodostamaan fibrillejä ja amyloidimaisia plakeja, ohittaen vaatimuksen PrPSc: n puhdistamiseksi tai aggregaattien liuottamiseksi.
PrPc on irrotettu entsymaattisesti kalvosta ja puhdistettu, ja sen rakennetta on tutkittu käyttämällä rakenteen karakterisointitekniikoita, kuten NMR-spektroskopiaa ja röntgenkristallografiaa . Translaation jälkeisessä PrPc: ssä on 231 aminohappoa (aa) hiirissä. Molekyyli koostuu pitkästä ja strukturoimattomasta aminopäätealueesta, joka ulottuu aa -tähteeseen 121 saakka, ja rakenteellisesta karboksipäätealueesta . Tässä pallomaisessa verkkotunnuksessa on kaksi lyhyttä arkin muodostavaa rinnakkaista β-juosetta (aa 128-130 ja aa 160-162 hiiren PrPc: ssä) ja kolme a-heliksiä (helix I: aa 143-153; helix II: aa 171-192 ; kierre III: aa 199-226 hiiren PrPc: ssä), heliksit II ja III ovat suuntaamaton suuntautuneet ja yhdistetty lyhyellä silmukalla. Niiden rakenteellista vakautta tukee disulfidisilta , joka on yhdensuuntainen molempien levyn muodostavien β-juosteiden kanssa. Nämä α-kierukat ja β-arkki muodostavat PrPc: n pallomaisen domeenin jäykän ytimen.
PrPSc: tä aiheuttava sairaus on proteinaasi K -resistentti ja liukenematon. Yritettäessä puhdistaa se tartunnan saaneiden eläinten aivoista saadaan aina heterogeenisiä seoksia ja aggregoituja tiloja, joita ei voida kuvata NMR-spektroskopialla tai röntgenkristallografialla. On kuitenkin yleinen yksimielisyys siitä, että PrPSc sisältää suuren prosenttiosuuden tiukasti pinottuja β-arkkeja kuin normaali PrPc, mikä tekee proteiinin liukenemattomaksi ja vastustaa proteinaasia. Käyttämällä kryoelektronimikroskopian tekniikoita ja rakenteellisia mallintamismalleja, jotka perustuvat samanlaisiin yhteisiin proteiinirakenteisiin, on havaittu, että PrPSc sisältää ß-levyjä alueella aa 81–95-aa 171, kun taas karboksipääterakenne oletetaan säilyneen, säilyttäen disulfidi- linkitetty α-kierteinen konformaatio normaalissa PrPc: ssä. Nämä ß-levyt muodostavat yhdensuuntaisen vasenkätisen beeta-kierukan. Kolmen PrPSc-molekyylin uskotaan muodostavan ensisijaisen yksikön ja siten rakentavan perustan ns. Katalyyttinen aktiivisuus riippuu hiukkasen koosta. PrPSc-hiukkasilla, jotka koostuvat vain 14-28 PrPc-molekyylistä, on suurin tarttuvuus ja konversio.
Huolimatta PrPSc: n puhdistamisen ja karakterisoinnin vaikeudesta PrPc: n tunnetusta molekyylirakenteesta ja käyttämällä siirtogeenisiä hiiriä ja N-terminaalista deleetiota, voitaisiin päätellä patogeeniseen PrPSc: hen johtavan proteiinin väärinkäytön mahdolliset "kuumat kohdat" ja Folding@home voisi olla suuri arvo näiden vahvistamisessa. Tutkimuksissa havaittiin, että sekä prioniproteiinin ensisijainen että toissijainen rakenne voivat olla merkittäviä konversiolle.
Prioniproteiinigeenissä ( PRNP ) on yli kaksikymmentä mutaatiota , joiden tiedetään liittyvän ihmisen TSE: n perinnölliseen muotoon tai jotka liittyvät siihen suoraan [56], mikä osoittaa yksittäisiä aminohappoja tietyllä paikalla, todennäköisesti karboksidomeenin sisällä , voi vaikuttaa TSE -herkkyyteen.
PrPc: n translaation jälkeinen aminoterminaalinen alue koostuu tähteistä 23-120, jotka muodostavat lähes puolet täyspitkän kypsytetyn PrPc: n aminosekvenssistä. Aminopäätealueella on kaksi osaa, jotka voivat vaikuttaa konversioon. Ensinnäkin jäämät 52-90 sisältävät oktapeptiditoistoalueen (5 kertaa), joka todennäköisesti vaikuttaa alkuperäiseen sitoutumiseen (oktapeptiditoistojen kautta) ja myös varsinaiseen konversioon aa 108–124: n toisen osan kautta. Erittäin hydrofobinen AGAAAAGA sijaitsee aa -jäännöksen 113 ja 120 välissä ja sitä kuvataan oletetuksi aggregaatiopaikaksi, vaikka tämä sekvenssi vaatii sen viereisiä osia muodostamaan fibrillaarisia aggregaatteja.
Karboksipallomaisessa domeenissa kolmen kierukan joukossa tutkimus osoittaa, että helix II: lla on merkittävästi suurempi taipumus β-juosteen konformaatioon. Koska tähteiden 114-125 (osa strukturoimatonta N-terminaalista ketjua) välillä on suuri konformaatiojoustavuus ja helix II: n korkea β-juosteen taipumus, vain kohtuulliset muutokset ympäristöolosuhteissa tai vuorovaikutuksessa voivat riittää aiheuttamaan PrPc: n väärinkäytön ja sitä seuraava fibrillien muodostuminen.
Muut PrPc: n NMR-rakenteita koskevat tutkimukset osoittivat, että nämä tähteet (~ 108–189) sisältävät suurimman osan taitetusta domeenista, mukaan lukien molemmat β-juosteet, kaksi ensimmäistä a-heliksiä ja silmukat/käännösalueet, mutta eivät helix III . Pienet muutokset PrPc: n silmukka-/kierrosrakenteissa voivat olla tärkeitä myös muunnoksessa. Toisessa tutkimuksessa Riek et ai. osoitti, että kaksi pientä β-juosteen aluetta silmukan alueista ylävirtaan toimivat ytimen muodostuspaikkana silmukan/käännöksen ja a-kierteisten rakenteiden konformaatiomuunnoksessa PrPc: ssä β-arkkiin.
Muuntamisen energiakynnys ei ole välttämättä korkea. Taittumiskestävyys eli pallomaisen proteiinin vapaa energia sen ympäristössä on yhden tai kahden vetysidoksen alueella, mikä mahdollistaa siirtymisen isoformiin ilman suurta siirtymäenergiaa.
PrPc-molekyylien välisistä vuorovaikutuksista vastaavasti hydrofobisilla vuorovaikutuksilla on ratkaiseva rooli β-arkkien muodostumisessa, joka on PrPSc: n tunnusmerkki, koska levyt tuovat polypeptidiketjujen fragmentit lähelle toisiaan. Itse asiassa Kutznetsov ja Rackovsky osoittivat, että sairauksia edistävillä mutaatioilla ihmisen PrPc: ssä oli tilastollisesti merkitsevä taipumus lisätä paikallista hydrofobisuutta.
In vitro -kokeet osoittivat, että väärinkäytön kinetiikalla on alkuvaiheen vaihe, jota seuraa fibrillien muodostumisen nopea kasvuvaihe. On todennäköistä, että PrPc kulkee joidenkin välitilojen läpi, kuten ainakin osittain avautunut tai hajonnut, ennen kuin se lopulta päätyy osaksi amyloidikuitua.
Osallistumismallit
Kuten muut hajautetut tietotekniikkaprojektit , Folding@home on online -kansalaistieteellinen projekti. Näissä hankkeissa ei-asiantuntijat lisäävät tietokoneen prosessointitehoa tai auttavat analysoimaan ammattitieteilijöiden tuottamia tietoja. Osallistujat saavat vähän tai ei lainkaan ilmeistä palkkiota.
Kansalaistutkijoiden motiiveja on tutkittu, ja useimmat näistä tutkimuksista ovat osoittaneet, että osallistujat ovat motivoituneita osallistumaan altruistisista syistä; toisin sanoen he haluavat auttaa tiedemiehiä ja osallistua heidän tutkimuksensa etenemiseen. Monet kansalaistieteen osallistujat ovat kiinnostuneita tutkimusaiheesta ja pyrkivät hankkeisiin, jotka ovat heitä kiinnostavia aloja. Folding@home ei eroa tältä osin. Äskettäin yli 400 aktiiviselle osallistujalle tehty tutkimus paljasti, että he halusivat osallistua tutkimukseen ja että monilla oli ystäviä tai sukulaisia, joita Folding@home -tutkijat tutkivat.
Folding@home houkuttelee osallistujia, jotka ovat tietokoneen laitteiston harrastajia. Nämä ryhmät tuovat hankkeeseen huomattavaa asiantuntemusta ja pystyvät rakentamaan tietokoneita, joilla on kehittynyt prosessointiteho. Muut hajautetut tietotekniikkahankkeet houkuttelevat tällaisia osallistujia, ja projekteja käytetään usein vertailuun muokattujen tietokoneiden suorituskyvystä, ja tämä harrastuksen osa otetaan huomioon projektin kilpailullisuuden vuoksi. Yksilöt ja joukkueet voivat kilpailla siitä, kuka pystyy käsittelemään eniten tietokoneen prosessointiyksiköitä.
Tämä viimeisin Folding@home -tutkimus, johon sisältyi haastattelu ja online -ryhmien etnografinen havainnointi, osoitti, että laitteistoharrastajien tiimit voivat joskus työskennellä yhdessä ja jakaa parhaita käytäntöjä prosessointituloksen maksimoimiseksi. Tällaisista ryhmistä voi tulla käytännön yhteisöjä , joilla on yhteinen kieli ja verkkokulttuuri. Tämä osallistumismalli on havaittu muissa hajautetuissa tietokonehankkeissa.
Toinen keskeinen havainto Folding@home -osallistujista on, että monet ovat miehiä. Tämä on havaittu myös muissa hajautetuissa hankkeissa. Lisäksi monet osallistujat työskentelevät tietokone- ja teknologiapohjaisissa tehtävissä ja urassa.
Kaikki Folding@home -osallistujat eivät ole laitteiston harrastajia. Monet osallistujat käyttävät projektiohjelmistoa muokkaamattomilla koneilla ja osallistuvat kilpailuun. Folding@home -ohjelmaan osallistuu yli 100 000 osallistujaa. On kuitenkin vaikea tietää, mikä osuus osallistujista on laitteiston harrastajia. Vaikka projektipäälliköiden mukaan harrastajayhteisön panos on huomattavasti suurempi prosessointitehon suhteen.
Esitys

Supertietokoneen FLOPS -suorituskyky arvioidaan suorittamalla vanha LINPACK -vertailuarvo. Tällä lyhytaikaisella testauksella on vaikeuksia heijastaa tarkasti jatkuvaa suorituskykyä todellisissa tehtävissä, koska LINPACK yhdistää tehokkaammin supertietokonelaitteistoon. Tietokonejärjestelmät eroavat arkkitehtuuriltaan ja suunnittelultaan, joten suora vertailu on vaikeaa. Tästä huolimatta FLOPS on edelleen supertietokoneiden ensisijainen nopeusmittari. Sitä vastoin Folding@home määrittää FLOPSinsa käyttämällä seinäkelloaikaa mittaamalla, kuinka kauan työyksiköiden suorittaminen kestää.
16. syyskuuta 2007, suurelta osin PlayStation 3 -konsolien osallistumisen vuoksi, Folding@home -projekti saavutti virallisesti korkeamman suorituskyvyn kuin yksi alkuperäinen petaFLOPS , ja siitä tuli ensimmäinen kaikenlainen tietokonejärjestelmä. Top500 : n nopein supertietokone oli tuolloin BlueGene/L , 0.280 petaFLOPS. Seuraavana vuonna, 7. toukokuuta 2008, projekti saavutti jatkuvan suorituskyvyn, joka oli korkeampi kuin kaksi natiivia petaFLOPSia, ja sen jälkeen kolme ja neljä alkuperäistä petaFLOPS -virstanpylvästä elokuussa 2008 ja 28. syyskuuta 2008. Folding@home saavutti 18. helmikuuta 2009 viisi alkuperäistä petaFLOPS -ohjelmaa ja oli ensimmäinen laskentaprojekti, joka täytti nämä viisi tasoa. Vertailun vuoksi marraskuun 2008 nopein supertietokone oli IBM : n Roadrunner 1.105 petaFLOPS. 10. marraskuuta 2011 Folding@homen suorituskyky ylitti kuusi alkuperäistä petaFLOPSia, mikä vastaa lähes kahdeksaa x86 petaFLOPSia. Toukokuun puolivälissä 2013 Folding@home saavutti yli seitsemän alkuperäistä petaFLOPSia, mikä vastaa 14,87 x86 petaFLOPSia. Sitten se saavutti kahdeksan alkuperäistä petaFLOPSia 21. kesäkuuta, jota seurasi yhdeksän saman vuoden 9. syyskuuta, 17,9 x86 petaFLOPS. 11. toukokuuta 2016 Folding@home ilmoitti siirtyvänsä kohti 100 x86 petaFLOPS -merkkiä.
Lisäkäyttö kasvoi koronaviruspandemian aiheuttamasta tietoisuudesta ja hankkeeseen osallistumisesta vuonna 2020. 20.3.2020 Folding@home ilmoitti Twitterissä, että se käyttää yli 470 natiivia petaFLOPSia, mikä vastaa 958 x86 petaFLOPSia. 25. maaliskuuta mennessä se saavutti 768 petaFLOPS eli 1,5 x86 exaFLOPS, joten se oli ensimmäinen exaFLOP -tietokonejärjestelmä . 20. marraskuuta 2020 Folding@home sisältää vain 0,2 x86 exaFLOPS -laskentavirheen vuoksi.
Pisteet
Samoin kuin muut hajautetut tietotekniikkaprojektit, Folding@home arvioi kvantitatiivisesti käyttäjien laskennallisia osuuksia projektissa luottojärjestelmän kautta. Kaikilla tietyn proteiiniprojektin yksiköillä on yhtenäinen perusluotto, joka määritetään vertaamalla yksi tai useampi projektin työyksikkö virallisella viitekoneella ennen projektin julkaisua. Jokainen käyttäjä saa nämä peruspisteet jokaisen työyksikön suorittamisesta, mutta salasanan avulla he voivat saada lisäpisteitä luotettavasti ja nopeasti valmistuvista yksiköistä, jotka ovat vaativampia laskennallisesti tai joilla on suurempi tieteellinen etusija. Käyttäjät voivat myös saada tunnustusta työstään useiden koneiden asiakkailta. Tämä pistejärjestelmä yrittää sovittaa myönnetyn luoton tieteellisten tulosten arvoon.
Käyttäjät voivat rekisteröidä osallistumisensa tiimiin, joka yhdistää kaikkien jäsentensä pisteet. Käyttäjä voi perustaa oman tiimin tai liittyä olemassa olevaan tiimiin. Joissakin tapauksissa tiimillä voi olla omat yhteisölähtöiset avun tai rekrytoinnin lähteet, kuten Internet-foorumi . Pisteet voivat edistää ystävällistä kilpailua yksilöiden ja tiimien välillä, jotta he voisivat laskea eniten hankkeelle, mikä voi hyödyttää kokoontaitettavaa yhteisöä ja nopeuttaa tieteellistä tutkimusta. Yksilö- ja tilastointi julkaistaan Folding@home -verkkosivustolla.
Jos käyttäjä ei muodosta uutta tiimiä tai ei liity olemassa olevaan tiimiin, hänestä tulee automaattisesti osa oletustiimiä. Tämän "Oletus" -joukkueen joukkueen numero on "0". Tilastot kerätään tältä "oletus" -tiimiltä sekä erityisesti nimetyiltä joukkueilta.
Ohjelmisto
Folding@home -ohjelmisto käyttäjän lopussa sisältää kolme pääosaa: työyksiköt, ytimet ja asiakas.
Työyksiköt
Työyksikkö on proteiinidata, jota asiakasta pyydetään käsittelemään. Työyksiköt ovat murto -osa Markov -mallin tilojen välisestä simulaatiosta . Kun työyksikkö on ladattu ja käsitelty kokonaan vapaaehtoisen tietokoneella, se palautetaan Folding@home -palvelimille, jotka myöntävät vapaaehtoiselle luottopisteet. Tämä sykli toistuu automaattisesti. Kaikilla työyksiköillä on määräajat, ja jos tämä määräaika ylitetään, käyttäjä ei välttämättä saa luottoa ja yksikkö lähetetään automaattisesti toiselle osallistujalle. Koska proteiinien taittuminen tapahtuu sarjassa ja monet työyksiköt syntyvät edeltäjistään, tämä mahdollistaa koko simulointiprosessin etenemisen normaalisti, jos työyksikköä ei palauteta kohtuullisen ajan kuluttua. Näiden määräaikojen vuoksi Folding@home -järjestelmän vähimmäisjärjestelmävaatimus on Pentium 3450 MHz: n suoritin, jossa on Streaming SIMD Extensions (SSE). Tehokkaiden asiakkaiden työyksiköillä on kuitenkin paljon lyhyempi määräaika kuin yksiprosessorisella asiakkaalla, koska suuri osa tieteellisestä hyödystä riippuu nopeasti suoritettavista simulaatioista.
Ennen julkista julkaisua työyksiköt käyvät läpi useita laadunvarmistusvaiheita , jotta ongelmalliset eivät tule täysin saataville. Näihin testausvaiheisiin kuuluu sisäinen, beeta- ja edistynyt versio ennen lopullista täydellistä julkaisua Folding@home -sivustolla. Folding@home -työyksiköt käsitellään yleensä vain kerran, paitsi harvinaisissa tapauksissa, joissa virheitä ilmenee käsittelyn aikana. Jos tämä koskee kolmea eri käyttäjää, laite poistetaan jakelusta automaattisesti. Folding@home -tukifoorumin avulla voidaan erottaa toisistaan ongelmalliset laitteistot ja huonot työyksiköt.
Ytimet
Erikoistuneet molekyylidynamiikan ohjelmat, joihin viitataan nimellä "FahCores" ja usein lyhennetty "ytimet", suorittavat laskelmat työyksikössä taustaprosessina . Valtaosa Folding @ home: n ytimet perustuvat Gromacs , yksi nopeimmista ja suosituin molekyylidynamiikka ohjelmistopaketteja, joka koostuu lähinnä manuaalisesti optimoitu konekielellä koodin ja laitteiston optimointeja. Vaikka GROMACS on avoimen lähdekoodin ohjelmisto ja Pande labin ja GROMACS-kehittäjien välillä tehdään yhteistyötä, Folding@home käyttää suljetun lähdekoodin lisenssiä tietojen oikeellisuuden varmistamiseksi. Vähemmän aktiivisia ytimiä ovat ProtoMol ja SHARPEN. Folding@home on käyttänyt AMBER- , CPMD- , Desmond- ja TINKER -laitteita , mutta nämä ovat sittemmin jääneet eläkkeelle eivätkä ole enää aktiivipalvelussa. Jotkut näistä ytimistä suorittavat selkeitä solvaatiolaskelmia , joissa ympäröivä liuotin (yleensä vesi) on mallinnettu atomi-atomi; toiset suorittavat implisiittisiä solvaatiomenetelmiä , joissa liuotinta käsitellään matemaattisena jatkumona. Ydin on erillään asiakkaasta, jotta tieteelliset menetelmät voidaan päivittää automaattisesti ilman, että asiakas tarvitsee päivitystä. Ytimet luovat määräajoin laskennan tarkistuspisteitä, jotta ne voivat keskeytettyään jatkaa työtä siitä kohdasta käynnistyksen yhteydessä.
Asiakas
Taitettava @ home osallistuja asentaa client ohjelma heidän henkilökohtainen tietokone . Käyttäjä on vuorovaikutuksessa asiakkaan kanssa, joka hallinnoi muita ohjelmiston osia taustalla. Asiakas voi keskeyttää taittoprosessin, avata tapahtumalokin, tarkistaa työn edistymisen tai tarkastella henkilökohtaisia tilastoja. Tietokoneasiakkaat toimivat jatkuvasti taustalla erittäin alhaisella prioriteetilla ja käyttävät joutokäyntitehoa, jotta tietokoneen normaali käyttö ei muutu. Suorittimen enimmäiskäyttöä voidaan säätää asiakasasetusten kautta. Asiakas muodostaa yhteyden Folding@home -palvelimeen ja hakee työyksikön ja voi myös ladata sopivan ytimen asiakkaan asetuksiin, käyttöjärjestelmään ja taustalla olevaan laitteistoarkkitehtuuriin. Käsittelyn jälkeen työyksikkö palautetaan Folding@home -palvelimille. Tietokoneasiakkaat on räätälöity yksiprosessorisille ja moniydinprosessorijärjestelmille sekä grafiikkaprosessointiyksiköille . Kunkin laitteistoarkkitehtuurin monimuotoisuus ja teho tarjoavat Folding@homelle mahdollisuuden suorittaa tehokkaasti monenlaisia simulaatioita ajoissa (muutamassa viikossa tai kuukaudessa eikä vuosissa), mikä on merkittävää tieteellistä arvoa. Yhdessä nämä asiakkaat antavat tutkijoille mahdollisuuden tutkia biolääketieteellisiä kysymyksiä, joita aiemmin pidettiin epäkäytännöllisinä laskennallisesti.
Ammattitaitoiset ohjelmistokehittäjät ovat vastuussa suurimmasta osasta Folding@home-koodia sekä asiakas- että palvelinpuolella. Kehitystiimiin kuuluu Nvidian , ATI: n , Sonyn ja Cauldron Developmentin ohjelmoijia . Asiakkaat voidaan ladata vain viralliselta Folding@home -verkkosivustolta tai sen kaupallisilta kumppaneilta, ja he ovat vuorovaikutuksessa vain Folding@home -tietokonetiedostojen kanssa. He lataavat ja lataavat tietoja Folding@home-datapalvelimilla ( portin 8080 kautta, vaihtoehtoisena 80) ja tiedonsiirto tarkistetaan käyttämällä 2048-bittisiä digitaalisia allekirjoituksia . Vaikka asiakkaan graafinen käyttöliittymä (GUI) on avoimen lähdekoodin, asiakas on ohjelmisto, jonka syynä ovat turvallisuus ja tieteellinen eheys.
Tämä perusteltu oikeus käyttää ohjelmistoa on kuitenkin kiistetty, koska vaikka lisenssi voitaisiin panna täytäntöön laillisella alalla takautuvasti, se ei käytännössä estä suoritettavien binaaritiedostojen muuttamista (tunnetaan myös nimellä korjaus ) . Samoin vain binäärinen jakelu ei estä suoritettavan binaarikoodin haitallista muuttamista joko man-in-the-middle-hyökkäyksen kautta, kun se ladataan Internetin kautta, tai kolmannen osapuolen binaaritiedostojen uudelleenjakelusta. aiemmin muokattu joko binääritilassaan (eli patched ) tai purkamalla ja kääntämällä ne uudelleen muokkaamisen jälkeen. Nämä muutokset ovat mahdollisia, ellei binääritiedostoja - ja siirtokanavaa - ole allekirjoitettu ja vastaanottaja/järjestelmä voi varmistaa digitaalisen allekirjoituksen, jolloin perusteettomat muutokset pitäisi havaita, mutta ei aina. Kummassakin tapauksessa, koska Folding@home-tapauksessa asiakasohjelmiston käsittelemät syöttötiedot ja tulostulos ovat molemmat digitaalisesti allekirjoitettuja, työn eheys voidaan tarkistaa itsenäisesti asiakasohjelmiston eheydestä riippumatta.
Folding@home käyttää verkottamiseen Cosm -ohjelmistokirjastoja. Folding@home lanseerattiin 1. lokakuuta 2000, ja se oli ensimmäinen biomolekulaarisiin järjestelmiin suunnattu hajautettu laskentaprojekti. Sen ensimmäinen asiakas oli näytönsäästäjä , joka toimisi tietokoneen ollessa muuten käyttämättä. Vuonna 2004 Pande-laboratorio teki yhteistyötä David P.Andersonin kanssa testatakseen täydentävää asiakasta avoimen lähdekoodin BOINC- kehyksessä. Tämä asiakas julkaistiin suljetulle betalle huhtikuussa 2005; menetelmästä tuli kuitenkin toimimaton ja se hylättiin kesäkuussa 2006.
Grafiikan prosessointiyksiköt
Grafiikkaprosessointiyksiköiden (GPU) erikoislaitteisto on suunniteltu nopeuttamaan kolmiulotteisten grafiikkaohjelmien, kuten videopelien, hahmontamista, ja ne voivat merkittävästi ylittää suorittimet tietyntyyppisissä laskelmissa. GPU: t ovat yksi tehokkaimmista ja nopeasti kasvavista laskentaympäristöistä, ja monet tutkijat ja tutkijat harjoittavat yleiskäyttöistä tietojenkäsittelyä grafiikkaprosessointiyksiköissä (GPGPU). GPU-laitteistoa on kuitenkin vaikea käyttää muihin kuin grafiikkatehtäviin ja se vaatii yleensä merkittäviä algoritmien uudelleenjärjestelyjä ja edistyneen ymmärryksen taustalla olevasta arkkitehtuurista. Tällainen mukauttaminen on haastavaa erityisesti tutkijoille, joilla on rajalliset ohjelmistokehitysresurssit. Folding@home käyttää avoimen lähdekoodin OpenMM- kirjastoa , joka käyttää sillan suunnittelumallia, jossa on kaksi sovellusohjelmointirajapinnan (API) tasoa, liittääkseen molekyylisimulaatio-ohjelmiston taustalla olevaan laitteistoarkkitehtuuriin. Laitteiston optimoinnin lisäksi OpenMM-pohjaiset GPU-simulaatiot eivät tarvitse merkittäviä muutoksia, mutta niiden suorituskyky on lähes yhtä suuri kuin käsin viritetty GPU-koodi, ja ne ylittävät huomattavasti CPU-toteutukset.
Ennen vuotta 2010 GPGPU-kuluttajatason laitteiston laskentavarmuus oli suurelta osin tuntematon, ja välilliset todisteet, jotka liittyivät sisäänrakennetun virheentunnistuksen ja -korjauksen puuttumiseen GPU-muistissa, herättivät luotettavuutta. Ensimmäisessä laajamittaisessa GPU: n tieteellisen tarkkuuden testissä vuonna 2010 tehty tutkimus, jossa oli mukana yli 20 000 Folding@home-verkon isäntää, havaitsi pehmeitä virheitä kahden kolmasosan testatuista grafiikkasuorittimista. Nämä virheet korreloivat vahvasti levyn arkkitehtuuriin, vaikka tutkimuksessa todettiin, että luotettava GPU-laskenta oli erittäin mahdollista, kunhan kiinnitetään huomiota laitteisto-ominaisuuksiin, kuten ohjelmistopuolen virheiden havaitsemiseen.
Folding@home -sovelluksen ensimmäisen sukupolven GPU-asiakasohjelma (GPU1) julkaistiin yleisölle 2. lokakuuta 2006, mikä nopeuttaa joidenkin laskelmien suorittamista 20–30 kertaa nopeammin kuin suoritinpohjaiset GROMACS- kollegansa. Se oli ensimmäinen kerta, kun GPU: ita käytettiin joko hajautetussa laskennassa tai suurissa molekyylidynamiikan laskelmissa. GPU1 antoi tutkijoille merkittävää tietoa ja kokemusta GPGPU -ohjelmiston kehittämisestä , mutta vastauksena DirectX: n tieteellisiin epätarkkuuksiin 10.4.2008 sitä seurasi asiakkaan toisen sukupolven GPU2. GPU2: n käyttöönoton jälkeen GPU1 poistettiin virallisesti käytöstä 6. kesäkuuta. Verrattuna GPU1: een, GPU2 oli tieteellisesti luotettavampi ja tuottavampi, se toimi ATI- ja CUDA -yhteensopivilla Nvidia -grafiikkasuorittimilla ja tuki kehittyneempiä algoritmeja, suurempia proteiineja ja reaaliaikaista visualisointia proteiinisimulaatiosta. Tämän jälkeen kolmannen sukupolven Folding@home's GPU client (GPU3) julkaistiin 25. toukokuuta 2010. Vaikka taaksepäin yhteensopiva GPU2: n kanssa, GPU3 oli vakaampi, tehokkaampi ja joustavampi tieteellisissä kyvyissään ja käytti OpenMM: ää OpenCL -kehys . Vaikka nämä GPU3 -asiakkaat eivät luonnollisesti tukeneet Linux- ja macOS -käyttöjärjestelmiä , Linux -käyttäjät, joilla on Nvidia -näytönohjain, pystyivät suorittamaan ne Wine -sovelluksen kautta. GPU: t ovat Folding@home: n tehokkain alusta FLOPSissa . Marraskuussa 2012 GPU -asiakkaiden osuus 87% koko projektin x86 FLOPS -kapasiteetista.
Nvidian ja AMD -näytönohjainten alkuperäinen tuki Linuxissa otettiin käyttöön FahCore 17: ssä, joka käyttää OpenCL: ää CUDA: n sijasta.
PlayStation 3
Maaliskuusta 2007 marraskuuhun 2012 Folding@home hyödynsi PlayStation 3: n laskentatehoa . Tuolloin alusta, sen tärkein streaming Cell prosessori antoi 20 kertaa nopeus kasvaa yli PC: laskelmia, laskentatehoa, jota ei löydy muista järjestelmistä, kuten Xbox 360 . PS3: n nopea nopeus ja tehokkuus toivat muita mahdollisuuksia hyödyllisiin optimointeihin Amdahlin lain mukaan ja muuttivat merkittävästi laskennan tehokkuuden ja yleisen tarkkuuden välistä kompromissia, mikä mahdollisti monimutkaisempien molekyylimallien käytön pienillä lisäkustannuksilla. Tämän ansiosta Folding@home pystyi suorittamaan biolääketieteellisiä laskelmia, jotka olisivat muuten olleet laskennallisesti mahdottomia.
PS3 -asiakasohjelma kehitettiin yhteistyössä Sonyn ja Pande -laboratorion kanssa, ja se julkaistiin ensimmäisen kerran erillisenä asiakkaana 23. maaliskuuta 2007. Sen julkaisun myötä Folding@home on ensimmäinen PS3 -tietokoneita käyttävä hajautettu tietotekniikkaprojekti. Seuraavan vuoden 18. syyskuuta PS3 -asiakkaasta tuli Life with PlayStation -kanava sen julkaisun yhteydessä. Laskentatyypeissä, joita se voi suorittaa, asiakas esitteli käyttöönoton yhteydessä CPU: n joustavuuden ja GPU: n nopeuden. Toisin kuin henkilökohtaisilla tietokoneilla toimivat asiakkaat , käyttäjät eivät kuitenkaan pystyneet suorittamaan muita toimintoja PS3: llaan Folding@home -käytön aikana. PS3: n yhtenäinen konsoliympäristö helpotti teknistä tukea ja teki Folding@home -käyttäjäystävällisemmäksi . PS3 pystyi myös suoratoistamaan tietoja nopeasti GPU: lle, jota käytettiin reaaliaikaiseen atomitason visualisointiin nykyisestä proteiinidynamiikasta.
Sony lopetti 6. marraskuuta 2012 Folding@home PS3 -asiakkaan ja muiden Life with PlayStation -palvelun tuen. Viiden vuoden ja seitsemän kuukauden elinkaaren aikana yli 15 miljoonaa käyttäjää antoivat yli 100 miljoonaa tuntia Folding@home -tietokonetta, mikä auttoi suuresti hanketta sairaustutkimuksessa. Pande -laboratorion kanssa käytyjen keskustelujen jälkeen Sony päätti lopettaa sovelluksen. Pande piti PlayStation 3 -asiakasta projektin "pelimuutoksena".
Monisydäminen prosessointi-asiakas
Folding@home voi käyttää nykyaikaisten moniydinsuorittimien rinnakkaislaskentaominaisuuksia . Mahdollisuus käyttää useita CPU -ytimiä samanaikaisesti mahdollistaa simulaation suorittamisen paljon nopeammin. Yhteistyössä nämä suoritinydimet suorittavat yksittäiset työyksiköt suhteellisesti nopeammin kuin tavallinen yksiprosessoriohjelma. Tämä menetelmä on tieteellisesti arvokas, koska se mahdollistaa paljon pidemmät simulaatioradat saman ajan kuluessa ja vähentää perinteisiä vaikeuksia suuren simulaation skaalaamisessa monille erillisille prosessoreille. Vuoden 2007 julkaisu Journal of Molecular Biology -lehdessä perustui moniydinprosessointiin simuloimaan osan villinproteiinin osaa taittumista noin 10 kertaa pidempään kuin yhden prosessorin asiakas, mikä oli mahdollista kokeellisen taittumisnopeuden mukaisesti.
Marraskuussa 2006 ensimmäisen sukupolven symmetriset moniprosessointi (SMP) -asiakkaat julkaistiin julkisesti avoimeen betatestaukseen, jota kutsutaan SMP1: ksi. Nämä asiakkaat käyttivät MPI ( Message Passing Interface ) -yhteyskäytäntöjä rinnakkaiskäsittelyyn, sillä tuolloin GROMACS -ytimiä ei ollut suunniteltu käytettäväksi useiden säikeiden kanssa. Tämä oli ensimmäinen kerta, kun hajautettu tietotekniikkaprojekti käytti MPI: tä. Vaikka asiakkaat toimivat hyvin Unix -pohjaisissa käyttöjärjestelmissä, kuten Linuxissa ja macOS: ssa, he olivat ongelmallisia Windowsissa . 24. tammikuuta 2010 SMP2, toisen sukupolven SMP asiakkaiden ja seuraaja SMP1 -isoamylaasi, julkaistiin avoimena beta ja korvasi monimutkainen MPI kanssa luotettavampi säiettä -toteutusta.
SMP2 tukee bigadv -työyksiköiden erityisluokan kokeilua , joka on suunniteltu simuloimaan epätavallisen suuria ja laskennallisesti intensiivisiä proteiineja, joilla on suuri tieteellinen prioriteetti. Nämä yksiköt alunperin vaadittu vähintään kahdeksan ydintä, joka nostettiin kuuteentoista myöhemmin, 7. helmikuuta 2012. Yhdessä nämä lisätty laitteistovaatimukset tavalliseen SMP2 työpanosyksikköinä ne vaativat enemmän järjestelmäresursseja kuten hakumuisti (RAM) ja Internet -kaistanleveys . Vastineeksi käyttäjät, jotka käyttävät näitä, palkitaan 20% korotuksella SMP2: n bonuspistejärjestelmään verrattuna. Bigadv -luokan avulla Folding@home voi suorittaa erityisen vaativia simulaatioita pitkiä aikoja, jotka olivat aiemmin vaatineet supertietokoneiden klustereiden käyttöä ja joita ei voitu suorittaa missään muualla Folding@home -sivustossa. Monien käyttäjien, joilla on laitteisto, joka pystyy käyttämään bigadv -yksiköitä, on myöhemmin katsottu, että laitteistoasetukset eivät kelpaa bigadv -työyksiköille, kun suorittimen ydinminimiä nostettiin, jolloin he pystyivät käyttämään vain tavallisia SMP -työyksiköitä. Tämä turhautti monia käyttäjiä, jotka investoivat ohjelmaan huomattavia summia vain saadakseen laitteistonsa vanhentuneeksi bigadv -tarkoituksiin pian sen jälkeen. Tämän seurauksena Pande ilmoitti tammikuussa 2014, että bigadv -ohjelma päättyy 31. tammikuuta 2015.
V7

V7 -asiakas on Folding@home -asiakasohjelmiston seitsemäs ja viimeisin sukupolvi, ja se on aiempien asiakkaiden täydellinen uudelleenkirjoitus ja yhdistäminen Windows- , macOS- ja Linux -käyttöjärjestelmille. Se julkaistiin 22. maaliskuuta 2012. Kuten edeltäjänsä, V7 voi käyttää Folding@home -ohjelmaa taustalla erittäin alhaisella prioriteetilla , jolloin muut sovellukset voivat käyttää suoritinresursseja tarpeen mukaan. Se on suunniteltu tekemään asennuksesta, käynnistyksestä ja toiminnasta käyttäjäystävällisempää aloittelijoille ja tarjoamaan enemmän tieteellistä joustavuutta tutkijoille kuin aiemmat asiakkaat. V7 käyttää Trac varten hoitamalla vika lippuja niin, että käyttäjät voivat nähdä sen kehitysprosessia ja antaa palautetta.
V7 koostuu neljästä integroidusta elementistä. Käyttäjä on yleensä vuorovaikutuksessa V7: n avoimen lähdekoodin graafisen käyttöliittymän kanssa , jonka nimi on FAHControl. Siinä on Novice-, Advanced- ja Expert -käyttöliittymätilat, ja sillä voidaan valvoa, konfiguroida ja ohjata monia etätaitettavia asiakkaita yhdestä tietokoneesta. FAHControl ohjaa FAHClient, joka on back-end sovellus, joka puolestaan hallinnoi kunkin FAHSlot (tai slot ). Jokainen paikka toimii korvaavana aiemmin erillisille Folding@home v6 -yhdistelmä-, SMP- tai GPU -tietokoneasiakkaille, koska se voi ladata, käsitellä ja ladata työyksiköitä itsenäisesti. FAHViewer-toiminto, joka on mallinnettu PS3: n katseluohjelman mukaan, näyttää reaaliaikaisen kolmiulotteisen renderöinnin, jos saatavilla, parhaillaan käsiteltävästä proteiinista.
Google Chrome
Vuonna 2014 julkaistiin Google Chromen ja Chromiumin verkkoselainten asiakas , jonka avulla käyttäjät voivat käyttää Folding@home -selainta. Asiakas käyttää Googlen n Native Client (NaCl) ominaisuus kromiperustaisia selaimet ajaa Folding @ home koodin äidinkielenomainen nopeudella hiekkalaatikko käyttäjän koneen. NaCL: n asteittaisen poistamisen ja Folding@home -sivuston muutosten vuoksi web -asiakas suljettiin pysyvästi kesäkuussa 2019.
Android
Heinäkuussa 2015 Android -matkapuhelinten asiakas julkaistiin Google Playsta laitteille, joissa on Android 4.4 KitKat tai uudempi.
16. helmikuuta 2018 yhteistyössä Sonyn kanssa tarjottu Android -asiakas poistettiin Google Playsta. Suunnitelmista julkistettiin tulevaisuudessa avoimen lähdekoodin vaihtoehto.
Vertailu muihin molekyylisimulaattoreihin
Rosetta@home on hajautettu laskentaprojekti, jonka tavoitteena on proteiinirakenteen ennustaminen ja joka on yksi tarkimmista tertiäärisen rakenteen ennustajista. Rosettan ohjelmiston konformaatiotiloja voidaan käyttää alustamaan Markov -tilamalli Folding@home -simulaatioiden lähtökohtina. Sitä vastoin rakenteen ennustamisalgoritmeja voidaan parantaa termodynaamisista ja kineettisistä malleista ja proteiinien taittosimulaatioiden näytteenottopiirteistä. Koska Rosetta yrittää vain ennustaa lopullisen taitetun tilan eikä sitä, miten taitto etenee, Rosetta@home ja Folding@home täydentävät toisiaan ja käsittelevät hyvin erilaisia molekyylikysymyksiä.
Anton on erityinen supertietokone, joka on rakennettu molekyylidynamiikan simulaatioita varten. Lokakuussa 2011 Anton ja Folding@home olivat kaksi tehokkainta molekyylidynamiikkajärjestelmää. Anton on ainutlaatuinen kyvyssä tuottaa yksittäisiä erittäin pitkiä laskennallisesti kalliita molekyylipolkuja, kuten yksi vuonna 2010, joka saavutti millisekunnin alueen. Nämä pitkät liikeradat voivat olla erityisen hyödyllisiä tietyntyyppisille biokemiallisille ongelmille. Anton ei kuitenkaan käytä Markovin tilamalleja (MSM) analyyseihin. Vuonna 2011 Pande-laboratorio rakensi MSM: n kahdesta 100 µs: n Anton-simulaatiosta ja löysi vaihtoehtoisia taittoreittejä, jotka eivät olleet näkyvissä Antonin perinteisen analyysin avulla. He päättivät, että rajallisesta määrästä pitkiä lentoreittejä tai monista lyhyemmistä reiteistä koottujen MSM: ien välillä ei ollut juurikaan eroa. Kesäkuussa 2011 Folding@home lisäsi näytteenottoa Anton -simulaatiosta, jotta sen menetelmät voisivat paremmin verrata Antonin menetelmiin. Kuitenkin toisin kuin Folding@home lyhyemmät liikeradat, jotka soveltuvat paremmin hajautetulle laskennalle ja muille rinnakkaistamismenetelmille, pidemmät reitit eivät edellytä mukautuvaa näytteenottoa proteiinin vaihetilan riittävän näytteenottoa varten . Tästä syystä on mahdollista, että Antonin ja Folding@home -simulaatiomenetelmien yhdistelmä antaisi perusteellisemman näytteenoton tästä tilasta.
Katso myös
Viitteet
Lähteet
- Folding@home (nde), "About" , Folding@home , haettu 26. huhtikuuta 2020
- Mims, Christopher (8. marraskuuta 2010), "Miksi Kiinan uusi supertietokone on vain teknisesti maailman nopein" , Technology Review , MIT, arkistoitu alkuperäisestä 21. syyskuuta 2012 , haettu 20. syyskuuta 2012
- News 12 Long Island (toukokuu 13, 2020) aikana, Hofstra University l napa resurssi laboratorioon maailmanlaajuisesti COVID-19 tutkimusta , haetaan päivänä toukokuuta 24, 2020
- Pande, Vijay S. (10. marraskuuta 2008), "Re: ATI- ja NVIDIA -tilastot vs. PPD -numerot" , Folding Forum , viides viesti alhaalta, arkistoitu alkuperäisestä 21. syyskuuta 2012 , haettu 26. huhtikuuta 2020
Ulkoiset linkit





