Ihmisen beetaherpesvirus 5 -Human betaherpesvirus 5
| Ihmisen sytomegalovirus | |
|---|---|
| Erikoisuus | Tarttuva tauti |
| Syyt | Ihmisen beetaherpesvirus 5 |
| Ihmisen beetaherpesvirus 5 | |
|---|---|

|
|
| Ihmisen keuhkojen pneumosyyttien CMV -infektio | |
|
Virusten luokittelu |
|
| (järjestämättä): | Virus |
| Valtakunta : | Duplodnaviria |
| Kuningaskunta: | Heunggongvirae |
| Pylum: | Peploviricota |
| Luokka: | Herviviricetes |
| Tilaus: | Herpesvirus |
| Perhe: | Herpesviridae |
| Suku: | Sytomegalovirus |
| Laji: |
Ihmisen beetaherpesvirus 5
|
| Synonyymit | |
|
|
Ihmisen betaherpesvirus 5 , jota kutsutaan myös ihmisen sytomegaloviruksen ( HCMV ), on lajien viruksen suvun sytomegalovirus , joka puolestaan on jäsen viruksen perheen tunnetaan Herpesviridae tai herpesvirukset. Sitä kutsutaan myös yleisesti CMV: ksi . Sisällä Herpesviridae HCMV kuuluu Betaherpesvirinae alaheimoon, johon kuuluu myös sytomegaloviruksista muista nisäkkäistä . CMV on kaksijuosteinen DNA-virus .
Vaikka niitä voi esiintyä koko kehossa, HCMV -infektiot liittyvät usein sylkirauhasiin . HCMV -infektio on tyypillisesti huomaamaton terveillä ihmisillä, mutta voi olla hengenvaarallinen immuunipuutteisille , kuten HIV -tartunnan saaneille henkilöille, elinsiirron vastaanottajille tai vastasyntyneille . Synnynnäinen sytomegalovirusinfektio voi johtaa merkittävään sairastuvuuteen ja jopa kuolemaan. Tartunnan jälkeen HCMV pysyy piilevänä kehossa koko elämän ajan ja voidaan aktivoida uudelleen milloin tahansa. Lopulta se voi aiheuttaa mukoepidermoidikarsinoomaa ja mahdollisesti muita pahanlaatuisia kasvaimia, kuten eturauhassyöpää ja rintasyöpää .
HCMV: tä esiintyy kaikilla maantieteellisillä alueilla ja kaikissa sosioekonomisissa ryhmissä, ja se tartuttaa 60–70% aikuisista kehittyneissä maissa ja lähes 100% kehitysmaissa . Kaikista herpesviruksista HCMV sisältää eniten geenejä, jotka on omistettu muuttamaan (kiertämään) synnynnäistä ja adaptiivista isännän immuniteettia, ja se on elinikäinen taakka antigeenisten T -solujen seurannasta ja immuunitoiminnan häiriöistä. Yleensä se on osoitettu vasta -aineiden esiintymisestä väestössä. Seroprevalenssi on iästä riippuvainen: 58,9% 6-vuotiaista ja sitä vanhemmista on CMV-tartunnan saaneita, kun taas 90,8% 80-vuotiaista ja sitä vanhemmista on HCMV-positiivisia. HCMV on myös virus, joka useimmiten tarttuu kehittyvään sikiöön . HCMV -infektio on yleisempi kehitysmaissa ja yhteisöissä, joilla on heikompi sosioekonominen asema, ja se on merkittävin synnynnäisten epämuodostumien virussyy teollisuusmaissa. Synnynnäinen HCMV on johtava tarttuvaa syy kuurous , oppimisvaikeudet ja kehitysvamma lapsilla. CMV: llä "näyttää myös olevan suuri vaikutus immuuniparametreihin myöhemmässä elämässä ja se voi lisätä sairastuvuutta ja mahdollisesti kuolleisuutta ".
Merkit ja oireet
Ihmisen beetaherpesvirus 5 -infektiolla on klassinen oireiden kolmikko: kuume , huippu myöhään iltapäivällä tai varhain illalla; nielutulehdus , yleensä eksudatiivinen; ja symmetrinen adenopatia .
Virologia
Tarttuminen
HCMV -tartuntatapa ihmisestä toiseen on tuntematon, mutta sen oletetaan tapahtuvan kehon nesteiden, mukaan lukien sylki , virtsa , veri ja kyyneleet, kautta . Sytomegalovirus tarttuu yleisimmin suudella ja yhdynnässä. Se voidaan myös siirtää tartunnan saaneelta äidiltä sikiölle. Tartunta edellyttää läheistä, läheistä kosketusta henkilön kanssa, joka erittää viruksen sylkeen , virtsaan tai muihin kehon nesteisiin. CMV voi tarttua seksuaalisesti ja rintamaidon välityksellä , ja sitä esiintyy myös siirrettävien elinten vastaanottamisen tai verensiirron kautta . Vaikka HCMV ei ole kovin tarttuva, sen on osoitettu leviävän kotitalouksissa ja pienten lasten keskuudessa päiväkodeissa.
Replikointi
HCMV replikoituu tartunnan saaneissa endoteelisoluissa hitaalla nopeudella ja kestää noin 5 päivää soluviljelmässä . Kuten muutkin herpesvirukset , HCMV ilmentää geenejä ajallisesti kontrolloidulla tavalla. Välittömät varhaiset geenit (0–4 tuntia tartunnan jälkeen) osallistuvat transkription säätelyyn , jota seuraavat varhaiset geenit (4–48 tuntia infektion jälkeen), jotka osallistuvat viruksen DNA: n replikaatioon ja edelleen transkription säätelyyn . Myöhäiset geenit ilmentyvät infektion jäljellä olevan ajan viruspoistumiseen asti ja tyypillisesti koodaavat rakenneproteiineja. Vaikka HCMV koodaa omaa toiminnallista DNA -polymeraasiaan , virus käyttää isäntä -RNA -polymeraasia kaikkien geeniensä transkriptioon.
Viruksen kaksijuosteisen DNA-genomin synteesi tapahtuu isäntäsolun ytimessä erikoistuneissa viruksen replikaatiolohkoissa.
Lähes 75% HCMV -kannan AD169 koodaamista geeneistä voidaan poistaa ja johtaa edelleen tarttuvan viruksen tuotantoon. Tämä viittaa siihen, että virus keskittyy välttämään isännän immuunijärjestelmää, jotta latenssi pääsee oikeaan aikaan .
Riskiryhmät
CMV -infektiot ovat merkittävimpiä perinataalikaudella ja immuunipuutteisilla ihmisillä.
Raskaus ja synnynnäinen infektio
HCMV on yksi vertikaalisesti tarttuvista infektioista, jotka johtavat synnynnäisiin poikkeavuuksiin. (Toiset ovat: toksoplasmoosi , vihurirokko ja herpes simplex .) Synnynnäinen HCMV -infektio tapahtuu, kun äiti kärsii ensisijaisesta infektiosta raskauden aikana.
Jopa 5 jokaista 1000 elävänä syntynyttä on saanut tartunnan. Viisi prosenttia kehittää useita haittoja ja kehittää sytomegalisen inkluusiotaudin, jolla on epäspesifisiä vihurirokkoa muistuttavia merkkejä. Toiset viisi prosenttia myöhemmin kehittävät aivojen kalkkeutumista (alentavat älykkyysosamäärää dramaattisesti ja aiheuttavat sensorineuraalista kuuroutta ja psykomotorista hidastumista).
Kuitenkin imeväiset, jotka ovat syntyneet ennenaikaisesti ja saaneet HCMV -infektion syntymän jälkeen, voivat kokea kognitiivisia ja motorisia vajaatoimintaa myöhemmin elämässään.
Immuunipuutteiset aikuiset
CMV -infektio tai uudelleenaktivointi ihmisillä, joiden immuunijärjestelmä on heikentynyt - esimerkiksi ihmiset, joille on tehty elinsiirtoja tai jotka ovat merkittävästi palanneet - aiheuttaa sairauksia ja lisää kuoleman riskiä.
CMV: n uudelleenaktivointia nähdään yleisesti ihmisillä, joilla on vaikea koliitti .
Näissä ihmisissä tunnistetut erityiset sairauskokonaisuudet ovat
- CMV -hepatiitti, joka voi aiheuttaa fulminanttia maksan vajaatoimintaa
- sytomegaloviruksen aiheuttama retiniitti (tulehdus verkkokalvon , tunnettu "pizza pie ulkonäkö" on oftalmoskopiaan )
- sytomegalovirus koliitti (tulehdus paksusuolen )
- CMV -keuhkotulehdus
- CMV -ruokatorvitulehdus
- polyradikulopatia, poikittainen myeliitti ja subakuutti enkefaliitti
Ihmiset, joilla ei ole CMV-infektiota ja joille on tehty elinsiirrot CMV-tartunnan saaneilta luovuttajilta, tarvitsevat ennaltaehkäisevää hoitoa valgansikloviirilla (mieluiten) tai gansikloviirilla ja säännöllistä serologista seurantaa nousevan CMV-tiitterin havaitsemiseksi; hoidettaessa mahdollisesti hengenvaarallisen infektion varhainen syntyminen voidaan estää.
Immunokompetentit aikuiset
CMV -infektioilla voi silti olla kliinistä merkitystä aikuisten immuunikompetenttien populaatioiden kohdalla.
- CMV -mononukleoosi (jotkut lähteet varaavat "mononukleoosin" vain Epstein -Barr -virukselle ). Kuitenkin CMV: hen liittyvästä mononukleoosi -oireyhtymästä puuttuu tyypillisesti merkkejä kohdunkaulan imusolmukkeiden laajentumisesta ja splenomegaliasta .
- CMV: hen on myös liittynyt Guillain -Barrén oireyhtymä , tyypin 1 diabetes ja tyypin 2 diabetes.
Kysymystä siitä, onko piilevällä CMV -infektiolla kielteisiä vaikutuksia muuten terveisiin ihmisiin, on keskusteltu; vuodesta 2016 lähtien vastaus ei ollut selvä, mutta keskustelut olivat keskittyneet siihen, voisiko piilevä CMV lisätä joidenkin sydän- ja verisuonitautien ja syöpien riskiä .
Patogeneesi
Useimmilla terveillä ihmisillä, jotka ovat saaneet HCMV -tartunnan syntymän jälkeen, ei ole oireita. Jotkut kehittävät tarttuvan mononukleoosin tai rauhaskuumeen kaltaisen oireyhtymän , johon liittyy pitkittynyt kuume ja lievä hepatiitti . Kurkkukipu on yleistä. Tartunnan jälkeen virus pysyy piilevänä kehon lymfosyyteissä koko loppuelämän. Avointa tautia esiintyy harvoin, ellei immuniteettia tukahduta joko lääkkeet, infektiot tai vanhuus. Alkuperäistä HCMV -infektiota, joka on usein oireeton , seuraa pitkäaikainen, epäselvä infektio, jonka aikana virus asuu mononukleaarisoluissa aiheuttamatta havaittavia vaurioita tai kliinistä sairautta.
Tarttuva CMV voi levitä minkä tahansa tartunnan saaneen henkilön kehon nesteisiin, ja sitä löytyy virtsasta , syljestä , verestä , kyyneleistä , siemennesteestä ja rintamaidosta . Irtoaminen virus voi tapahtua ajoittain, ilman mitään havaittavaa merkkejä tai oireita.
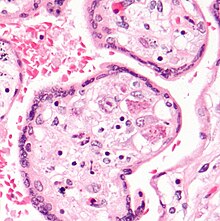
CMV -infektio voidaan osoittaa mikroskooppisesti havaitsemalla ytimen sisäisiä inkluusiokappaleita . Käytössä H & E värjäys , inkluusiokappaleet tahra tumma pinkki ja kutsutaan "pöllön silmä" inkluusiokappaleiden.
HCMV-infektio on tärkeä tietyille riskiryhmille. Suurimpia infektioriskialueita ovat synnytystä edeltävät tai synnytyksen jälkeiset imeväiset ja immuunipuutteiset yksilöt, kuten elinsiirron saajat, leukemiaa sairastavat tai ihmisen immuunikatoviruksella ( HIV ) infektoituneet . HIV -tartunnan saaneilla henkilöillä HCMV: tä pidetään AIDSia määrittävänä infektiona , mikä osoittaa, että T -solujen määrä on laskenut alhaiselle tasolle.
Lytisesti replikoituvat virukset häiritsevät sytoskeletonia aiheuttaen massiivista solujen laajentumista, joka on viruksen nimen lähde.
Vuonna 2009 julkaistu tutkimus yhdistää CMV -tartunnan hiirien korkeaan verenpaineeseen ja viittaa siihen, että ihmisen verisuonen endoteelin CMV -infektion tulos on merkittävä ateroskleroosin syy . Tutkijat havaitsivat myös, että kun solut saivat CMV -tartunnan, he loivat reniinin , proteiinin, jonka tiedetään edistävän korkeaa verenpainetta.
CMV koodaa proteiinia, UL16 , joka osallistuu NK -soluvasteiden immuunivälitteeseen . Se sitoutuu ligandeihin ULBP-1- , ULBP2 ja MICB NK-solun aktivoivan reseptorin NKG2D , joka estää niiden pinnalla ilmentymistä. Näitä ligandeja säännellään normaalisti solun stressin aikoina, kuten virusinfektiossa, ja estämällä niiden ylössäätelyn CMV voi estää isäntäsolunsa kuolevan NK -solujen vuoksi
Merkittävä osa immuunijärjestelmästä osallistuu CMV: n jatkuvaan hallintaan, mikä kuluttaa immuunijärjestelmän resursseja. Tartuntatautien kuolleisuus nopeutuu iän myötä, ja CMV -infektio korreloi rokotuksen tehon heikkenemisen kanssa . Henkilöillä, joilla on korkeimmat CMV -vasta -aineet, on paljon suurempi kuolemanriski kaikista syistä verrattuna henkilöihin, joilla on vähän tai ei lainkaan vasta -aineita.
Diagnoosi
Useimmat CMV -infektiot jäävät diagnosoimatta, koska virus tuottaa yleensä vain vähän tai ei lainkaan oireita ja pyrkii aktivoitumaan ajoittain uudelleen ilman oireita. Ihmiset, jotka ovat saaneet CMV -tartunnan, kehittävät virukselle vasta -aineita, jotka pysyvät kehossa kyseisen yksilön eliniän ajan. Useita laboratoriokokeita, jotka havaitsevat nämä CMV -vasta -aineet, on kehitetty sen määrittämiseksi, onko infektio tapahtunut, ja ne ovat laajalti saatavilla kaupallisista laboratorioista. Lisäksi virusta voidaan viljellä virtsasta, kurkunpyyhkeistä, keuhkoputkien huuhtelusta ja kudosnäytteistä saaduista näytteistä aktiivisen infektion havaitsemiseksi. Saatavilla on myös sekä kvalitatiivinen että kvantitatiivinen polymeraasiketjureaktion (PCR) testaus CMV: tä varten, jolloin lääkärit voivat seurata CMV -tartunnan saaneiden ihmisten viruskuormaa .
CMV-pp65-antigenemiatesti on immunofluoresenssipohjainen määritys, jossa käytetään epäsuoraa immunofluoresenssitekniikkaa sytomegaloviruksen pp65-proteiinin tunnistamiseksi perifeerisen veren leukosyyteissä. CMV pp65 -määritystä käytetään laajalti CMV -infektion ja sen vasteen antiviraaliseen hoitoon seurantaan ihmisillä, jotka ovat immunosuppressiivista hoitoa ja joille on tehty munuaisensiirtoleikkaus, koska antigenemiatulokset saadaan noin 5 päivää ennen oireisen CMV -taudin puhkeamista. Tämän määrityksen etuna on tulosten saamisen nopeus muutamassa tunnissa ja se, että pp65 -antigeenin määritys on hyödyllinen kriteeri lääkärille viruslääkityksen aloittamiselle. Suurin haitta pp65 -määrityksessä on, että vain rajallinen määrä näytteitä voidaan käsitellä testi -erää kohden.
CMV: tä tulisi epäillä, jos henkilöllä on tarttuvan mononukleoosin oireita, mutta hänellä on negatiivisia testituloksia mononukleoosista ja Epstein -Barr -viruksesta tai jos heillä on merkkejä hepatiitista, mutta hepatiitti A: n , B : n ja C: n testitulokset ovat negatiiviset .
Parhaan diagnostisen tuloksen saavuttamiseksi CMV -vasta -aineen laboratoriokokeet on suoritettava käyttämällä pariksi liitettyjä seeruminäytteitä. Yksi verinäyte tulee ottaa epäiltynä CMV: stä ja toinen verinäyte kahden viikon kuluessa. Virusviljely voidaan suorittaa milloin tahansa, kun henkilöllä on oireita. CMV -vasta -aineiden laboratoriotestaus voidaan suorittaa sen määrittämiseksi, onko naisella jo ollut CMV -infektio. Kaikkien raskaana olevien naisten rutiinitestaus on kuitenkin kallista, ja siksi testin tarve olisi arvioitava tapauskohtaisesti.
Serologinen testaus
Entsyymiin liittyvä immunosorbenttimääritys (tai ELISA ) on yleisimmin saatavilla oleva serologinen testi CMV-vasta-aineen mittaamiseksi. Tulosta voidaan käyttää määrittämään, onko lapsessa akuutti infektio, aikaisempi infektio tai passiivisesti hankittu äidin vasta -aine. Muita testejä ovat erilaiset fluoresenssimääritykset, epäsuora hemagglutinaatio (PCR) ja lateksin agglutinaatio .
Saatavilla on ELISA-tekniikka CMV-spesifiselle IgM: lle , mutta se voi antaa vääriä positiivisia tuloksia, ellei ryhdytä toimenpiteisiin reumatoidisen tekijän tai suurimman osan IgG- vasta-aineen poistamiseksi ennen seeruminäytteen testaamista. Koska CMV-spesifistä IgM: ää voidaan tuottaa pieninä määrinä uudelleenaktivoidussa CMV-infektiossa, sen läsnäolo ei aina viittaa primaariseen infektioon. Vain virus, joka on toipunut kohde -elimestä, kuten keuhkoista, antaa yksiselitteistä näyttöä siitä, että nykyinen sairaus johtuu hankitusta CMV -infektiosta. Jos serologiset testit havaitsevat positiivisen tai korkean IgG -tiitterin, tätä tulosta ei tule automaattisesti tulkita siten, että aktiivinen CMV -infektio on läsnä. Aktiivisen CMV -infektion katsotaan olevan läsnä, jos parillisten seeruminäytteiden vasta -ainetestit osoittavat nelinkertaisen nousun IgG -vasta -aineessa ja huomattavan määrän IgM -vasta -ainetta (vähintään 30% IgG -arvosta) tai jos virus viljellään virtsasta tai kurkun näyte.
Merkitys verenluovuttajille
Vaikka edellä mainitut riskit ovat yleensä pieniä, CMV-määritykset ovat osa suunnatonta verenluovutuksen (luovutuksia, joita ei ole määritetty tietylle henkilölle) tavanomaista seulontaa Yhdysvalloissa, Yhdistyneessä kuningaskunnassa ja monissa muissa maissa. CMV-negatiiviset lahjoitukset on sitten tarkoitettu verensiirtoon imeväisille tai immuunipuutteisille ihmisille. Jotkut verenluovutuskeskukset ylläpitävät luetteloita luovuttajista, joiden veri on CMV -negatiivinen erityisvaatimusten vuoksi.
Merkitys luuytimen luovuttajille
Allogeenisen hematopoieettisen kantasolusiirron aikana on yleensä suositeltavaa sovittaa luovuttajan ja vastaanottajan serostatus. Jos vastaanottaja on seronegatiivinen, seropositiivisella luovuttajalla on riski saada uusi infektio. Sitä vastoin seropositiivinen vastaanottaja on alttiina viruksen uudelleenaktivoitumiselle, jos hän saa siirron seronegatiiviselta luovuttajalta ja menettää luontaisen puolustuskykynsä. Yleensä riski on suurin CMV -seropositiivisilla vastaanottajilla, joissa viruksen uudelleenaktivointi aiheuttaa merkittävän sairastuvuuden. Näistä syistä CMV -serologinen testaus on rutiininomaista sekä luuytimen luovuttajille että vastaanottajille.
Ehkäisy
Rokotus
Vaiheen 2 tutkimus CMV-rokotteen julkaistu 2009 osoitti tehoa 50% -the suojan on rajoitettu, ja useita aiheita supistui CMV-infektio huolimatta rokotuksen. Yhdessä tapauksessa havaittiin myös synnynnäinen CMV.
Vuonna 2013 Astellas Pharma aloitti henkilöille, jotka saivat hematopoieettisen kantasolusiirron vaiheen 3 kokeen CMV -deoksiribonukleiinihappo -DNA -sytomegalovirusrokotteen ASP0113 kanssa.
Vuonna 2015 Astellas Pharma aloitti terveillä vapaaehtoisilla vaiheen 1 kokeen sytomegalovirusrokotteella ASP0113.
Muita sytomegalovirusrokotekandidaatteja ovat CMV-MVA Triplex -rokote ja CMVpp65-A*0201-peptidirokote. Molemmat rokotekandidaatit ovat Hope of Cityn kansallisen lääketieteellisen keskuksen sponsoroimia . Vuodesta 2016 lähtien kehitys on kliinisen vaiheen 2 koevaiheessa.
Hygienia
Centers for Disease Control and Prevention (CDC) suosittaa säännöllinen käsienpesu, varsinkin kun vaippojen. Käsinpesua suositellaan myös lapsen ruokinnan, nenän tai suun pyyhkimisen tai lasten lelujen käsittelyn jälkeen.
Hoito
CMV: lle (CMV-IGIV) rikastettu hyperimmuuniglobuliini on immunoglobuliini G (IgG), joka sisältää standardoidun määrän vasta-aineita sytomegalovirukselle. Sitä voidaan käyttää munuaisten, keuhkojen, maksan, haiman ja sydämen siirtoon liittyvän sytomegalovirussairauden ennaltaehkäisyyn. Yksin tai yhdessä viruslääkkeen kanssa on osoitettu:
- Vähennä CMV: hen liittyvien sairauksien ja kuoleman riskiä joillakin suuririskisimmistä elinsiirron saaneista
- Tarjoa mitattavissa oleva pitkän aikavälin selviytymishyvitys
- Tuottaa minimaalisia hoitoon liittyviä sivuvaikutuksia ja haittavaikutuksia.
Gansikloviiri (Cytovene) -hoitoa käytetään potilaille, joilla on heikentynyt immuniteetti ja joilla on joko näköön liittyviä tai hengenvaarallisia sairauksia. Valgansikloviiri (Valcyte) on viruslääke, joka on myös tehokas ja annetaan suun kautta: se on lääkeaine, joka muuttuu gansikloviiriksi kehossa, mutta imeytyy paljon paremmin suun kautta kuin jälkimmäinen. Lääkeresistenttien virusisolaattien syntyminen heikentää usein terapeuttista tehokkuutta. Useiden aminohappomuutosten UL97 -proteiinikinaasissa ja viruksen DNA -polymeraasissa on raportoitu aiheuttavan lääkeresistenssiä. Foscarnetia tai sidofoviiria annetaan vain ihmisille, joilla on gansikloviirille vastustuskykyinen CMV, koska foskarnetilla on huomattava munuaistoksisuus, mikä johtaa kohonneisiin tai vähentyneisiin Ca 2+ - tai PO 4 3− - ja alentuneisiin Mg 2+ -tasoihin.
Euroopan lääkevirasto ja FDA ovat hyväksyneet Letermovirin HCMV -infektion hoitoon ja ennaltaehkäisyyn.
Lääkekestävyys
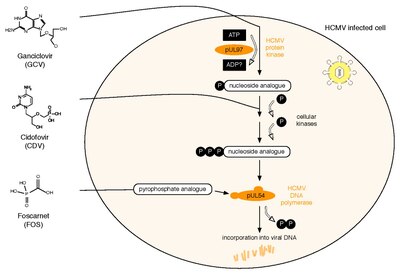
Kaikki kolme tällä hetkellä lisensoitua HCMV-vastaista lääkettä kohdistuvat viruksen DNA-polymeraasiin pUL54. Gansikloviiri (GCV) toimii nukleosidianalogina. Sen antiviraalinen aktiivisuus vaatii fosforylaatiota HCMV -proteiinikinaasilla, pUL97. Toinen lääke, Cidofovir (CDV), on nukleotidianalogi, joka on jo fosforyloitu ja siten aktiivinen. Lopuksi Foscarnetilla (FOS) on erilainen toimintatapa. Se estää suoraan polymeraasitoimintaa estämällä pUL54: n pyrofosfaatin sitoutumiskohdan (huomautus: tutkimuslääke letermoviiri toimii mekanismin kautta, johon liittyy viruksen terminaasi). Kaksi HCMV -proteiinia osallistuu virusten vastaiseen resistenssiin näitä kolmea lääkettä vastaan: pUL97 ja pUL54. PUL97: n spesifiset mutaatiot voivat aiheuttaa tämän virusproteiinikinaasin fosforylaatioaktiivisuuden heikkenemistä. Näin ollen vähemmän monofosforyloitua - ja siten aktiivista - GCV: tä voidaan syntetisoida, mikä johtaa virustenvastaiseen resistenssiin GCV: tä vastaan. Noin 90% kaikista GCV -resistansseista johtuu tällaisista mutaatioista UL97: ssä. Mutaatiot pUL54 voi olla erilaisia vaikutuksia, mikä johtaa antiviraalinen lääkeresistenssin : A. Ne voivat johtaa alentuneeseen affiniteetti antiviraaliset yhdisteet. Tämä resistenssimekanismi koskee GCV: tä, CDV: tä ja FOS: a ja voi johtaa monilääkeresistenssiin. B. Jotkut pUL54: n mutaatiot voivat lisätä polymeraasin eksonukleaasiaktiivisuutta . Tämä lisää sisällytetyn GCV: n ja CDV: n tunnistamista. Tämän seurauksena nämä dNTP -analogit poistetaan tehokkaammin. Suurimmat riskitekijät HCMV -lääkeresistenssille ovat isännän immuunijärjestelmän jäljellä oleva kyky hallita viruksen replikaatiota sekä viruksen replikaation kokonaismäärä ja kesto. HCMV -viruslääkeresistenssi voidaan havaita fenotyyppisellä tai genotyyppisellä lääkeresistenssitestillä. Fenotyyppisen resistenssin testaukseen kuuluu viruksen viljely soluviljelmässä ja sen herkkyyden testaaminen käyttämällä erilaisia viruslääkepitoisuuksia EC50 -arvojen määrittämiseksi . Sitä vastoin genotyyppinen resistenssitestaus tarkoittaa resistenssiin liittyvien mutaatioiden havaitsemista UL97: ssä ja UL54: ssä sekvensoimalla . Genotyyppisen resistenssin testaamisesta on tulossa valintamenetelmä, koska se on nopeampi, mutta vaatii jokaisen äskettäin löydetyn mutaation aikaisemman fenotyyppisen karakterisoinnin. Tämä voidaan suorittaa verkkopohjaisen hakutyökalun avulla, joka linkittää henkilön HCMV-sekvenssin tietokantaan, joka sisältää kaikki julkaistut UL97- ja UL54-mutaatiot ja vastaavat viruslääkeherkkyyden fenotyypit.
Epidemiologia
Yhdysvalloissa CMV -infektio kasvaa iän myötä noin 60 prosentista 6 -vuotiaista tartunnan saaneista, ja se tasoittuu noin 85–90 prosenttiin väestöstä 75–80 -vuotiaana.
Viitteet
Ulkoiset linkit
- Ihmisen beetaherpesvirus 5 , Curlie
- Cytomegalovirus (CMV) US Centers for Disease Control and Prevention (CDC). 22. toukokuuta 2009
- HCMV -lääkeresistenssin mutaatiotyökalu
- " Ihmisen herpesvirus 5 " . NCBI -taksonomiaselain . 10359.
| Luokitus |
|---|